1
SỞ GD – ĐT PHÚ YÊN
TRƯỜNG THPT NGÔ GIA TỰ
--------------
ĐỀ THI CHÍNH THỨC
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG LỚP 10, 11
NĂM HỌC 2019 - 2020
Môn thi: HÓA HỌC
Thời gian làm bài: 120 phút (không kể thời gian giao đề)
Đề thi gồm: 6 câu, 02 trang
-----------------------------------------------
Cho nguyên tử khối của các nguyên tố: H = 1; Li = 7; C = 12; N = 14; O = 16; Na = 23; Al = 27;
Mg = 24; S = 32; Cl = 35,5; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
Cho biết số hiệu nguyên tử của các nguyên tố: 1H; 2He; 6C; 7N; 8O; 9F; 10Ne; 11Na; 12Mg; 13Al; 16S; 17Cl;
18Ar; 19K; 20Ca; 24Cr; 26Fe; 29Cu; 30Zn; 35Br.
Câu I: (4 điểm)
1. Cho nguyên tố X, ở trạng thái cơ bản có 11 electron thuộc các phân lớp p. X có hai đồng vị
hơn kém nhau hai nơtron. Trong đồng vị số khối lớn, số hạt mang điện gấp 1,7 lần hạt không
mang điện.
a. Viết cấu hình electron của X.
b. Xác định vị trí của X trong bảng tuần hoàn.
c. Xác định thành phần cấu tạo của hai đồng vị và thành phần % theo khối lượng của mỗi đồng vị
trong X tự nhiên biết nguyên tử khối (NTK) trung bình của X bằng 35,48. Coi NTK có giá trị bằng
số khối.
2. Hợp chất X có công thức AxB2 (A là kim loại, B là phi kim). Biết trong nguyên tử B có số
notron nhiều hơn proton là 10, trong nguyên tử A số electron bằng số notron, trong 1 phân tử
AxB2 có tổng số proton bằng 82, phần trăm khối lượng của B trong X bằng 86,957%. Xác định
A, B.
Câu II: (3,5 điểm)
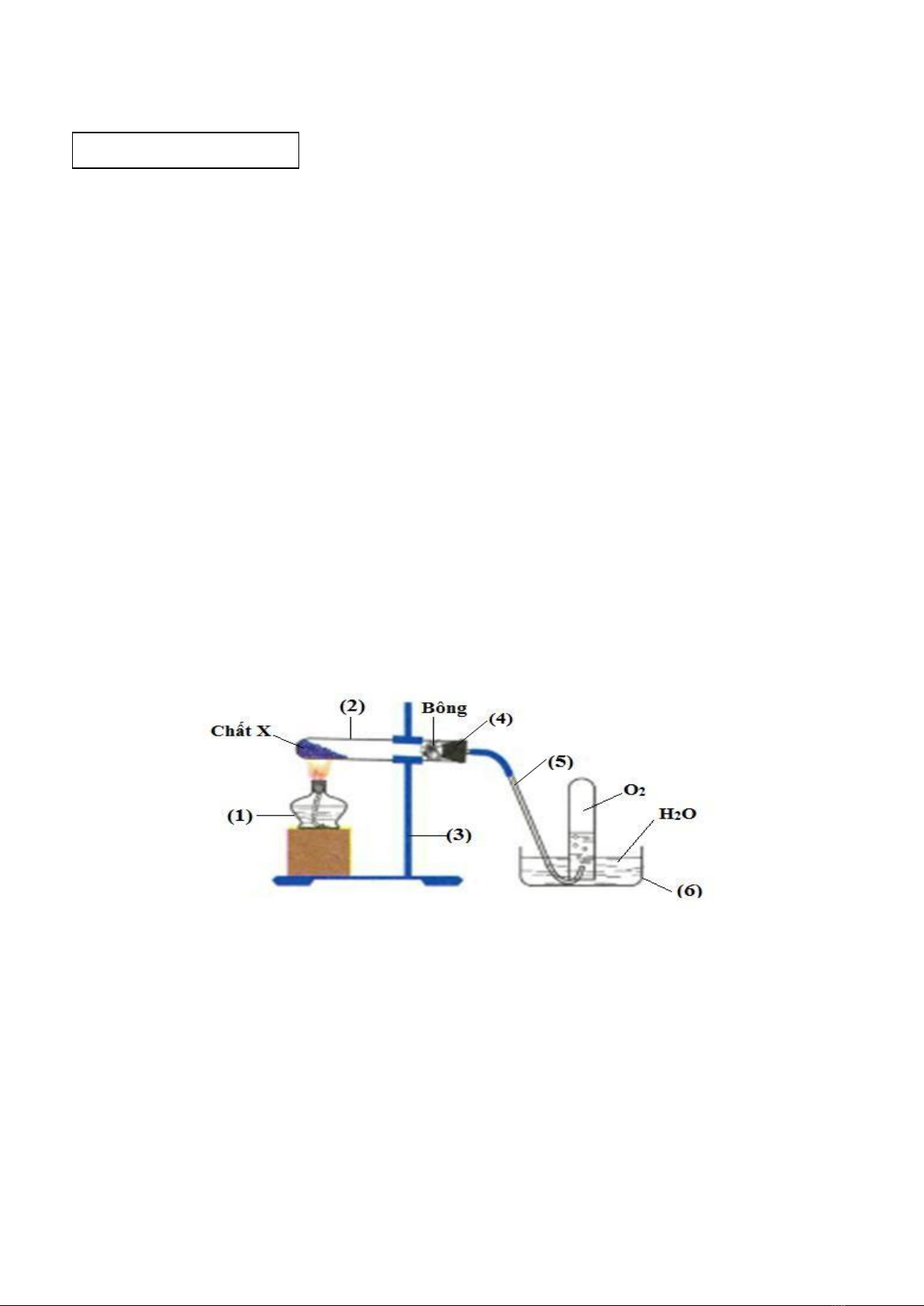
1. Cho sơ đồ điều chế khí O2 trong phòng thí nghiệm:
a. Nêu tên các dụng cụ thí nghiệm đã đánh số trong hình vẽ.
b. Chỉ ra hai chất có thể là X trong sơ đồ trên, viết phương trình phản ứng minh họa.
c. Hãy giải thích tại sao trong thí nghiệm trên?
-
Khí O2 lại được thu bằng phương pháp đẩy nước.
-
Khi kết thúc thí nghiệm phải tháo ống dẫn khí trước khi tắt đèn cồn.
2. Hoà tan hoàn toàn 5,4 gam một kim loại R bằng dung dịch H2SO4 đặc nóng dư, thu được SO2
(sản phẩm khử duy nhất). Cho toàn bộ lượng khí này hấp thụ hết vào 350 ml dung dịch
NaOH 2M. Sau phản ứng, cô cạn dung dịch thì thu được 41,8 gam chất rắn khan. Xác định R.
Câu III: (3,5 điểm)
1) Cân bằng các phương trình phản ứng sau theo phương pháp thăng bằng electron
a) MnO2 + HCl
MnCl2 + Cl2 + H2O
b) FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O.
c) CuFeSx + H2SO4(đặc)
0
t
Fe2(SO4)3 + CuSO4 + SO2 + H2O

2
2) Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
a. Sục từ từ khí sunfurơ đến dư vào cốc chứa dung dịch KMnO4.
b. Dẫn khí hiđro sunfua vào dung dịch nước clo, sau đó nhỏ vào dung dịch sau phản ứng vài
giọt dung dịch muối BaCl2.
c. Hai lọ hóa chất mở nắp để cạnh nhau: một lọ đựng dung dịch NH3 đậm đặc, một lọ đựng
dung dịch HCl đặc.
d. Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch NH3 loãng, sau đó thêm dung dịch
AlCl3 đến dư vào dung dịch sau phản ứng.
Câu IV: (5 điểm)
1. Cho các dung dịch sau có cùng nồng độ mol/lit:
NH4Cl, CH3COONH4, H2SO4, CH3COONa, HCl.
a. Em hãy viết các quá trình điện li khi hòa tan các chất trên vào nước.
b. Sắp xếp giá trị pH của các dung dịch trên theo thứ tự tăng dần. Giải thích ngắn gọn.
c. Dùng quỳ tím và một hóa chất khác, em hãy phân biệt năm dung dịch trên.
2. X là dung dịch hỗn hợp Ba(OH)2 và NaOH có cùng nồng độ aM, Y là dung dịch HCl có
pH = 1. Trộn 100 ml dung dịch X với 400 ml dung dịch Y, thu được 500 ml dung dịch Z có
pH = 12. Cô cạn dung dịch Z thu được m gam chất rắn khan. Tính a, m.
3. Hòa tan 0,42 gam KOH vào 100 ml dung dịch hỗn hợp CH3COOH 0,1M và HNO3 0,12M.
Sau khi kết thúc phản ứng, thu được dung dịch X. Tính nồng độ của ion CH3COO- ở thời điểm
cân bằng. Biết
3
5
()
1,75.10
a CH COOH
K
. Coi thể tích dung dịch không thay đổi.
Câu V: (2 điểm)
Dung dịch X chứa các ion: 𝐶𝑙−,𝐻𝐶𝑂3
−,𝐵𝑎2+,𝑁𝑎+ tổng số mol của 𝑁𝑎+ 𝑣à 𝐶𝑙− là 0,26 mol.
Chia X thành hai phần bằng nhau. Cho phần 1 phản ứng với lượng dư dung dịch NaOH, kết
thúc phản ứng thấy có 7,88 gam kết tủa xuất hiện. Cho dung dịch NaHSO4 tới dư vào phần 2,
sinh ra 1,12 lit khí CO2 (đktc). Tính tổng khối lượng muối trong dung dịch X.
Câu VI: (2 điểm)
Hòa tan hoàn toàn 9,52 gam hỗn hợp A gồm FexOy và FeS2 trong 48,51 gam dung dịch HNO3
phản ứng xong, thu được 1,568 lit khí NO2 (sản phẩm khử duy nhất, đktc) và dung dịch B.
Dung dịch B phản ứng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem nung trong
không khí đên khối lượng không đổi thu được 9,76 gam chất rắn.
a. Xác định công thức oxit FexOy
b. Tính nồng độ phần trăm của dung dịch HNO3.
Học sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học.
--------- Hết ---------
Họ và tên thí sinh:………………….………………………..Số báo danh:………………………..
Chữ kí giám thị 1:……………………………….. Chữ kí giám thị 2:……………….……………

3
SỞ GD – ĐT PHÚ YÊN
TRƯỜNG THPT NGÔ GIA TỰ
HƯỚNG DẪN CHẤM
KỲ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG LỚP 10
NĂM HỌC 2019 - 2020
MÔN THI: HÓA HỌC
Thời gian làm bài: 120 phút
Câu
Ý
Đáp án
Điểm
I
(4 điểm)
1a
Vì X có 11 electron thuộc phân lớp p
cấu hình electron đầy đủ: 1s22s22p63s23p5.
0,5
1b
Vị trí của X trong bảng tuần hoàn:
Ô số 17 vì có 17 electron
Chu kì 3 vì có 3 lớp electron.
Nhóm VII A vì cấu hình electron hóa trị là 3s23p5.
0,5
1c
P = E = 17
Gọi số khối đồng vị nhỏ A1, số khối đồng vị lớn A2
Trong đồng vị số khối lớn: 2P = 1,7 N2 N2 = 20; A2 = 37
N1 = 18; A1 = 35
Vậy thành phần cấu tạo các đồng vị của X là:
Đồng vị số khối nhỏ: 17 electron, 17 proton, 18 nơtron.
Đồng vị số khối lớn: 17 electron, 17 proton, 20 nơtron.
Gọi thành phần % theo số nguyên tử đồng vị nhỏ là x%
thành phần % theo số nguyên tử đồng vị lớn là (100 – x)%.
NTKTB (A) = A1.x% + A2. (100 – x)%
(17+18).x% + (17+20)(100-x)% = 35,48 x = 76%.
Xét 1 mol X (35,48 gam) có 0,76 mol 35X (0,76.35 = 26,6 gam)
thành phần % theo khối lượng 35X là: 26,6 : 35,48 = 74,97%
thành phần % theo khối lượng 37X là: 100% - 74,97% = 25,03%.
0,25
0,25
0,25
0,25
0,25
0,25
2
MX= 82*2+10*2= 184.
2*MB/184= 86,957% MB=80 B là Br gọi X là AxBr2
MA*x+ 160= 184 MA*x=24 x=1, MA=24 A là Mg.
0,5
0,5
0,5
II
(3,5
điểm)
1a
(1) Đèn cồn; (2) Ống nghiệm; (3) Giá đỡ.
(4) Nút cao su (5); Ống dẫn khí; (6) Chậu thủy tinh.
0,25
0,25
1b
X có thể là: KClO3, KMnO4. Hai phản ứng:
2KClO3 𝑡0
→ 2KCl + 3O2
2KMnO4 𝑡0
→ K2MnO4 + MnO2 + O2
0,25
0,25
1c
Giải thích:
+ Khí O2 rất ít tan trong nước, có M = 32 nặng hơn không khí (MKK=29)
không nhiều, nên được thu qua nước.
+ Phải tháo ống dẫn khí trước vì nếu tắt đèn cồn trước, sự chênh lệch áp suất sẽ
làm cho nước trào vào ống nghiệm, gây vỡ ống nghiệm.
0,5
0,5
2
- Số mol NaOH = 0,35 . 2 = 0,7 mol
- Phản ứng: SO2 + NaOH
NaHSO3
SO2 + 2NaOH
Na2SO3 + H2O
Nếu chất rắn là Na2SO3 thì khối lượng là: 0,35 . 126 = 44,1 gam
Nếu chất rắn là NaHSO3 thì khối lượng là: 0,7. 104 = 72,8 gam
Chất rắn thu được khi cô cạn dung dịch là 41,8 gam < (44,1; 72,8)
Chất rắn thu được gồm Na2SO3 và NaOH dư
0,25
0,25

4
- Đặt số mol của Na2SO3 là x
Số mol NaOH dư là 0,7-2.x
Ta có: 126.x + (0,7-2x) . 40 = 41,8 → x = 0,3 mol
Phản ứng: 2R + 2nH2SO4 đặc
o
t
R2(SO4)n + nSO2 + 2nH2O
nR =
0,6
n
mol MR = 9n
R là Al (nhôm)
0,5
0,5
III
(3,5
điểm)
1a
1x Mn+4 + 2e
Mn+2
2x 2Cl-
Cl2 + 2e
MnO2 + 4HCl
MnCl2 + Cl2 + 2H2O
0,25
0,25
1b
5x 2Fe+2 → 2Fe+3 + 2e
2x Mn+7 + 5e → Mn+2
10FeSO4 + 2KMnO4 + aKHSO4 → 5Fe2(SO4)3 + bK2SO4 + 2MnSO4 + cH2O
- Bảo toàn nguyên tố K, S => a = 16 ; b = 9 => c = 8
10FeSO4 + 2KMnO4 + 16KHSO4 → 5Fe2(SO4)3 + 9K2SO4 + 2MnSO4 + 8H2O
0,25
0,25
1c
2
4
64
23
2 2 1
2 (5 4
2 5 4
)
x
CuFeS Cu Fe x S
S e S x
2CuFeSx +(4x+10) H2SO4(đặc)
0
t
Fe2(SO4)3 + 2CuSO4 +(6x+5) SO2 +
(4x+10) H2O
0,25
0,25
2.a
Phương trình:
2 4 2 2 4 4 2 4
5SO +2KMnO +2H O K SO +2MnSO +2H SO
- Màu tím của dung dịch nhạt dần, cuối cùng mất màu hoàn toàn.
0,25
0,25
2.b
Phương trình:
2 2 2 2 4
2 2 4 4
H S+4Cl +4H O 8HCl+H SO
BaCl +H SO BaSO 2HCl
- Nước Cl2 nhạt màu, có kết tủa trắng xuất hiện.
0,25
0,25
2.c
Tạo ra khói trắng
3( ) ( ) 4 ( )k k r
NH HCl NH Cl
0,25
0,25
2.d
3NH3+ 3H2O +AlCl3
Al(OH)3 + 3NH4Cl
Hiện tượng: Dung dịch chuyển thành màu hồng, sau đó xuất hiện kết tủa keo
trắng và dung dịch mất màu.
0,25
0,25
IV
(5 điểm)
1a
+) NH4Cl NH4+ + Cl-
NH4+ + H2O NH3 + H3O+
+) CH3COONH4 CH3COO- + NH4+
CH3COO- + H2O CH3COOH + OH- (1)
NH4+ + H2O NH3 + H3O+ (2)
+) CH3COONa CH3COO- + Na+
CH3COO- + H2O CH3COOH + OH-
+) H2SO4 H+ + HSO4-
HSO4- + H2O SO42- + H3O+
0,25
0,25
0,25
0,25
1b
Sắp xếp các giá trị pH theo thứ tự tăng dần
+) H2SO4 < HCl < NH4Cl < CH3COONH4 < CH3COONa
+) Giải thích: với cùng nồng độ thì [H+] của H2SO4 > của HCl vì H2SO4
phân ly theo 2 nấc còn HCl chỉ phân ly theo 1 nấc.
[H+] của HCl > trong NH4Cl vì HCl phân ly hoàn toàn, còn NH4+ phân ly
không hoàn toàn
Quá trình ở (1) và (2) là tương đương nhau nên môi trường CH3COONH4 là
trung tính, pH7
CH3COONa có CH3COO- thủy phân cho OH- nên [H+] của dung dịch là nhỏ
nhất
0,25
0,25
0,25

5
Mà [H+] càng nhỏ thì pH càng cao thứ tự đúng H2SO4 < HCl < NH4Cl <
CH3COONH4 < CH3COONa
0,25
1c
Qùy tím
Ba(OH)2
NH4Cl
Đỏ
Khí, mùi khai
CH3COONH4
Không đổi mầu quỳ
H2SO4
Đỏ
Kết tủa trắng
CH3COONa
Xanh
HCl
Đỏ
Không có hiện tượng
+) Viết các phản ứng:
Ba(OH)2 + 2NH4Cl BaCl2 + 2NH3 + 2H2O
Ba(OH)2 + H2SO4 BaSO4 + 2H2O
Ba(OH)2 + 2HCl BaCl2 + 2H2O
0,5
0,25
IV
2
𝑛𝑂𝐻−= 0,3𝑎,𝑛𝐻+= 0,04
pH = 12 → [𝑂𝐻]−= 0,01
𝑇𝑎 𝑐ó 0,3a – 0,04 = 0,01*0,5
→ a = 0,15 (M)
{0,015 𝑚𝑜𝑙 𝐵𝑎(𝑂𝐻)2
0,015 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻 + 0,04 mol HCl → m + 0,04 mol H2O
m = 0,015*(171 + 40) + 0,04*36,5 – 0,04*18 = 3,905 gam
0,25
0,25
0,5
0,5
3
33
( ) ( ( )
0,0045
0,012 0,0075 0,0045 ; 0,045
0,1
HNO du M HNO du
n mol C M
3 3 2
33
2
(1)
0,1 0,045
(2)
KOH HNO KNO H O
CH COOH CH COO H
x x x
H O OH H
Ta có: Ka.CCH3COOH >>KW => chỉ xét (1)
55
( 0,045) 1,75.10 3,88.10
0,1
a
xx
Kx
x
.
Vậy [ CH3COO-] = 3,88.10-5M
0,25
0,25
0,25


![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








