
A. Các lo i hi u ng c u trúc trong hóa h c h u cạ ệ ứ ấ ọ ữ ơ
Trong phân t h p ch t h u c , các nguyên t có nh h ng tr c ti p ho c gián ti pử ợ ấ ữ ơ ử ả ưở ự ế ặ ế
l n nhau mà ph n l n do s khác nhau đ âm đi n gi a hai nguyên t liên k t. Các nhẫ ầ ớ ự ộ ệ ữ ử ế ả
h ng gián ti p nh v y đc g i là hi u ng electron. Ngoài ra, do nh h ng c a kíchưở ế ư ậ ượ ọ ệ ứ ả ưở ủ
th c các nguyên t ho c nhóm nguyên t còn có hi u ng không gian.ướ ử ặ ử ệ ứ
I. Hi u ng electronệ ứ
Electron là ti u phân linh đng nh t trong phân t , dù ch a tham gia liên k t hóa h cể ộ ấ ử ư ế ọ
ho c đã tham gia liên k t nó đu có th b d ch chuy n b i nh h ng t ng h c a cácặ ế ề ể ị ị ể ở ả ưở ươ ỗ ủ
nguyên t trong phân t .ử ử
S d ch chuy n m t đ electron đc phân thành hi u ng c m ng, hi u ng liênự ị ể ậ ộ ượ ệ ứ ả ứ ệ ứ
h p, hi u ng siêu liên h p và hi u ng tr ng.ợ ệ ứ ợ ệ ứ ườ
1. Hi u ng c m ng (Kí hi u: I, tên ti ng anh là Inductive effect)ệ ứ ả ứ ệ ế
1.1. B n ch t c a hi u ng c m ngả ấ ủ ệ ứ ả ứ
VD: CH3 – CH2 – CH3 µ = 0
3 2 1
CH3 – CH2 – CH2 – Cl µ = 1,8D (3+ < 2+ < 1+)
-Liên k t ế b phân c c v phía Cl làm C h i d ng và Cl h i âm, nh h ng đn liênị ự ề ơ ươ ơ ả ưở ế
k t ế và
-S phân c c c a m t liên k t c ng hóa tr là nguyên nhân chuy n d ch m t đ electronự ự ủ ộ ế ộ ị ể ị ậ ộ
c a các liên k t bên c nh v phía nguyên t âm đi n h n. nh h ng l ng c cσủ ế ạ ề ử ệ ơ Ả ưở ưỡ ự
c a liên k t c ng hóa tr truy n theo m ch các liên k t theo c ch c m ng.σủ ế ộ ị ề ạ ế ơ ế ả ứ
V y b n ch t c a hi u ng c m ng là s phân c c các liên k t lan truy n theo→ σậ ả ấ ủ ệ ứ ả ứ ự ự ế ề
m ch cacbon do s khác nhau v đ âm đi n liên k tạ ự ề ộ ệ ế
1.2. Phân lo i và quy lu t c a hi u ng c m ngạ ậ ủ ệ ứ ả ứ
-Quy c: nguyên t hidro liên k t v i cacbon trong C-H có hi u ng I = 0 (th c t :ướ ử ế ớ ệ ứ ự ế
liên k t C – H có phân c c nh ng r t y u)ế ự ư ấ ế
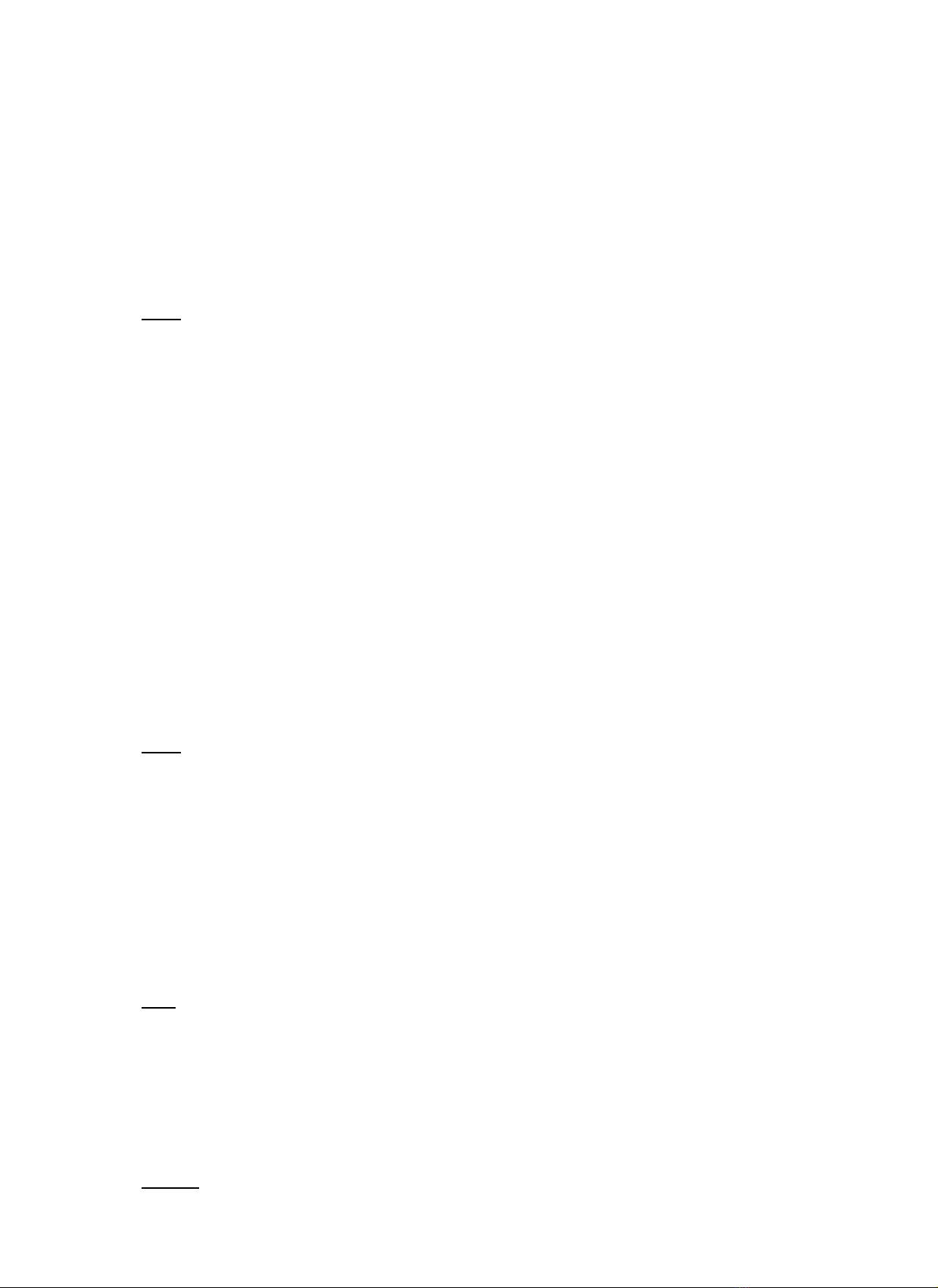
-Các nhóm th chuy n d ch m t đ electron c a liên k t m nh h n hidro th hi nσế ể ị ậ ộ ủ ế ạ ơ ể ệ
hi u ng –I: ệ ứ +NR3, - OR, -SR, -NR2, -X,…
+ -
C Y : Nhóm –I→
+ Hi u ng – I có đ l n tăng theo đ âm đi n c a nguyên t ho c nhóm nguyên tệ ứ ộ ớ ộ ệ ủ ử ặ ử
gây ra hi u ng đóệ ứ
VD:
-I < -Br < -Cl < -F
-NH2 < -OH < -F
Csp3 < Csp2 < Csp:
-CH=CH2 < -C6H5 < -C CH < - C N < - NO≡ ≡ 2
-C=C < -C=N < -C=O
- Các nhóm th cho electron làm nâng cao m t đ electron trong m ch liên k t so v iσế ậ ộ ạ ế ớ
nguyên t hidro, th hi n hi u ng +Iử ể ệ ệ ứ
+ -
X C : Nhóm +I→
+ Hi u ng +I tăng theo b c c a g c hidrocacbonệ ứ ậ ủ ố
VD:
-CH3 < -CH2 – CH3 < - CH(CH3)2 < -C(CH3)3
Các g c ankyl th hi n hi u ng +I trong dung d ch, trong pha khí chúng có th bi uố ể ệ ệ ứ ị ở ể ể
hi n c hi u ng –I (nghĩa là kéo electron m nh h n hidro).ệ ả ệ ứ ạ ơ
1.3. Đc đi mặ ể
-Hi u ng c m ng có đc đi m là gi m nhanh khi m ch cacbon truy n hi u ng đóệ ứ ả ứ ặ ể ả ạ ề ệ ứ
kéo dài
VD:
CH3 – CH2 – CH2 – COOH Ka = 1,5
CH3 – CH2 – CHCl – COOH Ka = 139 tăng 92 l nầ
CH3 – CHCl – CH2 – COOH Ka = 8 tăng 6 l nầ
CH2Cl – CH2 – CH2 – COOH Ka = 3 tăng 2 l nầ
L u ý:ư Hi u ng c m ng coi nh không b c n tr b i các y u t không gianệ ứ ả ứ ư ị ả ở ở ế ố
2. Hi u ng liên h p ( Kí hi u: C, tên ti ng anh là: Conjugative effect)ệ ứ ợ ệ ế
2.1. B n ch t và phân lo i hi u ng liên h pả ấ ạ ệ ứ ợ
-Trong h liên h p – (liên k t đôi, liên k t ba xen k các liên k t π π σệ ợ ế ế ẽ ế
ho c nguyên t còn c p electron không phân chia liên k t v i liên k t đôi ho c liên k tặ ử ặ ế ớ ế ặ ế
ba) n u có nguyên t ho c nhóm nguyên t hút electron v phía nó (do đ âm đi nế ử ặ ử ề ộ ệ
l n) các liên k t trong h đó s phân c c theo chi u nh t đnh (đc bi u th b ngπớ ế ệ ẽ ự ề ấ ị ượ ể ị ằ
mũi tên cong) g i là hi u ng liên h p âm (-C)ọ ệ ứ ợ
VD
Nhóm–C
Nhóm –C
-Trong h liên h p n – nguyên t hay nhóm nguyên t ch a c p electron n luôn đyπệ ợ ử ử ứ ặ ẩ
c p electron đó v phía liên k t c a h liên h p. Ta nói r ng nguyên t ho c nhómπặ ề ế ủ ệ ợ ằ ử ặ
nguyên t đó đã gây ra hi u ng liên h p d ng (+C)ử ệ ứ ợ ươ
VD
Nhóm +C Nhóm +C
-Phân lo i ạ
+C C 0 -C≡
X: -Cl, -F, -OH, -NH2… chu n =C=O, -COOH, -NOẩ2…
2.2. Quy lu t so sánh c a hi u ng liên h pậ ủ ệ ứ ợ
-Hi u ng –C c a nhóm –Y=Z tăng theo đ phân c c c a nhóm đóệ ứ ủ ộ ự ủ
=C=NH2 < =C=NH < =C=O
-N=O < -NO2
=C=NH2 < =C=NH2 < =C=O < -NO2
-Hi u ng +C c a X gi m theo chi u tăng kích th c nguyên t (kích th c c a obitanệ ứ ủ ả ề ướ ử ướ ủ
n) và gi m theo chi u tăng c a đ âm đi n n u kích th c nguyên t nh nhauả ề ủ ộ ệ ế ướ ử ư
-I < -Br < -Cl < -F
-F< -OH < -NH2
2.3. Đc đi mặ ể
- Khác v i hi u ng c m ng, hi u ng liên h p truy n qua h liên h p ch thay đi ítớ ệ ứ ả ứ ệ ứ ợ ề ệ ợ ỉ ổ
khi m ch liên h p đc kéo dàiạ ợ ượ
VD: M c đ gi m tính axit khi đa nhóm p-NOứ ộ ả ư 2C6H4- ra xa nhóm –COOH b ng ằ
–CH2-CH2- và –CH=CH-
pKa (p-O2NC6H4-COOH) : 3,43
pKa (p-O2NC6H4-CH2-CH2- COOH) : 4,48
pKa (p-O2NC6H4-CH=CH- COOH) : 4,05
-Hi u ng liên h p còn khác hi u ng c m ng ch nó ch xu t hi n trên h liên h pệ ứ ợ ệ ứ ả ứ ở ỗ ỉ ấ ệ ệ ợ
ph ng hay g n ph ng t c là h liên h p trong đó tr c c a các obitan và p song songπẳ ầ ẳ ứ ệ ợ ụ ủ
hay g n nh song song v i nhau vì h ph ng m i có s liên h p.ầ ư ớ ệ ẳ ớ ự ợ
L u ý:ư - H u h t các nhóm +C đng th i có c hi u ng –I nên th hi n m t hi uầ ế ồ ờ ả ệ ứ ể ệ ộ ệ
ng t ng quát bao g m c hai hi u ng đóứ ổ ồ ả ệ ứ
VD: CH3O là nhóm đy electron nói chung (+C > -I)ẩ
Nh ng Clo là nhóm hút electron nói chung (+C < -I)ư
Clo chuy n electron n c a mình sang liên k t Cl – C gây nên s d ch chuy n electron πể ủ ế ự ị ể
c a liên k t C=C sang nhóm =CHủ ế 2.Vì –I c a clo l n h n +C nên các nguyên t này đuủ ớ ơ ử ề
mang đi n tích d ngệ ươ
-Các nhóm –C th ng có đng th i c hi u ng –I nên tính hút electron càng m nhườ ồ ờ ả ệ ứ ạ
-M t s nhóm có hi u ng C v i d u không c đnh nh vinyl, fenyl…ộ ố ệ ứ ớ ấ ố ị ư
N
O
O
+C -C
NH
2
-C +C
K t qu tác đng t ng h p c a hai hi u ng và liên h p c a m t s nhóm th c thế ả ộ ổ ợ ủ ệ ứ ợ ủ ộ ố ế ụ ể
Nhóm thếHi u ng c m ngệ ứ ả ứ Hi u ng liên h pệ ứ ợ Tác đng t ng h pộ ổ ợ
Nhóm ankyl R +I -
-O-+I +C
Cho electron
-NH2, -NHR, -NR2-I +C
-OH, -OR -I +C
-NH3+, -NR3+-I -
Halogen -I +C
Nh n electronậ
=C=O -I -C
-COOH, -COOR -I -C
-NO2, -I -C
-C N≡-I -C
-SO3H -I -C
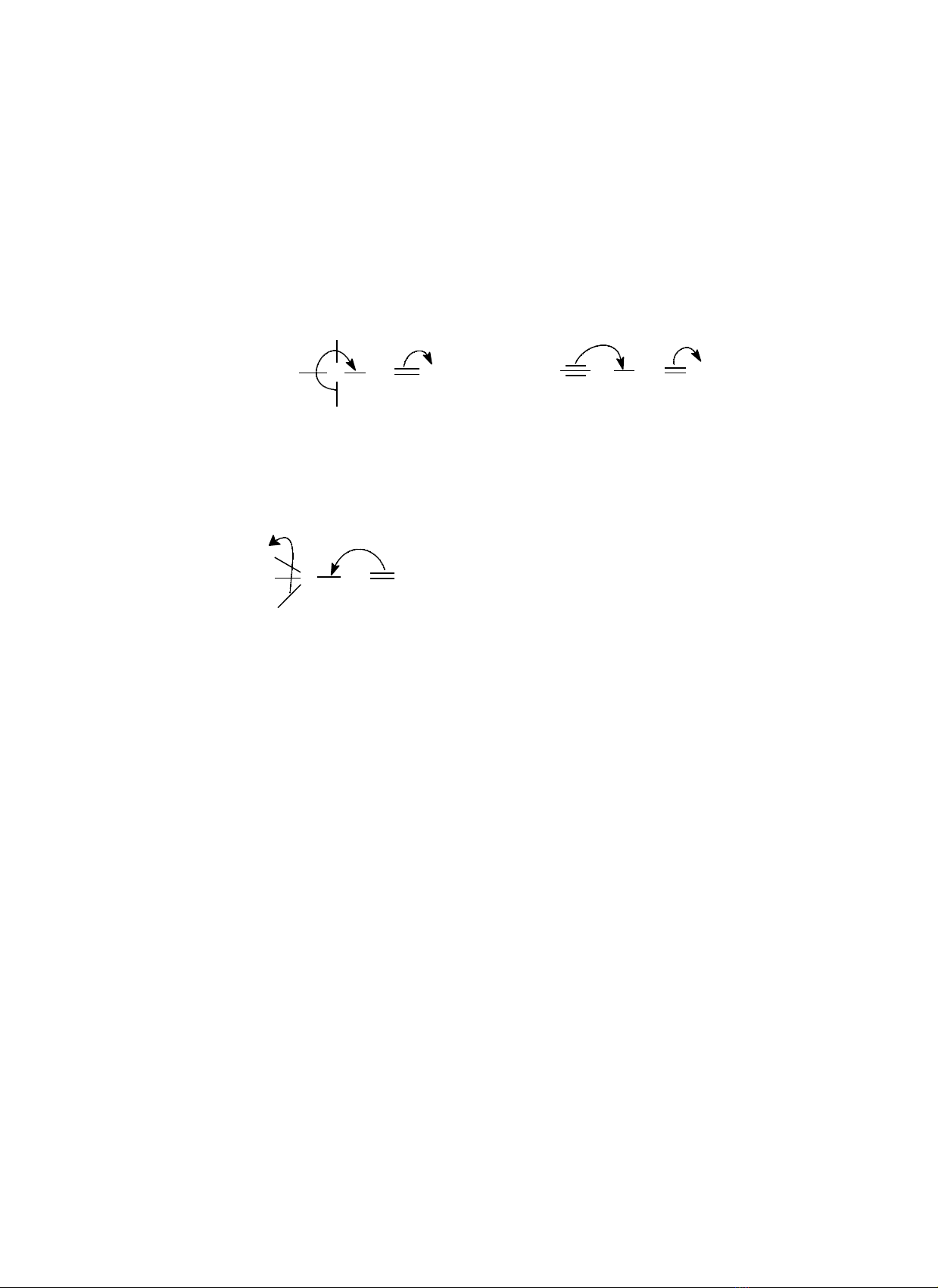
3. Hi u ng siêu liên h pệ ứ ợ
3.1. B n ch t và phân lo iả ấ ạ
-Khi v trí đi v i nguyên t cacbon không no có các liên k t Cαở ị ố ớ ử ế α-H thì xu t hi n sấ ệ ự
liên h p gi a Cợ ữ α-H v i C=C. Ng i ta nói r ng nhóm – CHớ ườ ằ 3 đã gây hi u ng siêu liênệ ứ
h p d ng (+H). Hi u ng này bi u di n b ng mũi tên cong c t ngang qua liên k tợ ươ ệ ứ ể ễ ằ ắ ế
Cα-H
HC
H
H
CH CH
2
hay H
3
C CH CH
2
-Khi v trí đi v i nguyên t C có các liên k t Cαở ị ố ớ ử ế α-F thì nhánh –CF3 s gây hi u ngẽ ệ ứ
siêu liên h p âm (-H)ợ
CHC
F
CH
2
F
F
3.2. Quy lu tậ
-Hi u ng +H s y u khi gi m s liên k t Cệ ứ ẽ ế ả ố ế α-H
-CH3 > -CH2-CH3 > -CH(CH3)2 > -C(CH3)3
VD: s linh đng c a H Cự ộ ủ ở α (Csp3) do hi u ng siêu liên h pệ ứ ợ
as
CH3 – COOH + Cl2 CH→2Cl – COOH + HCl
4. Hi u ng tr ngệ ứ ườ
-nh h ng c a nhóm th đn trung tâm ph n ng đc truy n không ph i qua liênẢ ưở ủ ế ế ả ứ ượ ề ả
k t mà tr c ti p qua không gian ho c qua phân t dung môi theo c ch t ng tácế ự ế ặ ử ơ ế ươ
l ng c c – l ng c c t o nên hi u ng tr ng, kí hi u Fưỡ ự ưỡ ự ạ ệ ứ ườ ệ
-Vi c phân bi t hi u ng c m ng và hi u ng tr ng r t khó v m t th c nghi m.ệ ệ ệ ứ ả ứ ệ ứ ườ ấ ề ặ ự ệ
Hi u ng tr ng ph thu c vào hình h c c a phân t và v trí tác d ng khi các nhómệ ứ ườ ụ ộ ọ ủ ử ị ụ
t ng tác g n nhau trong không gianươ ầ

























