
Höôùng daãn giaûi ñeà soá 6
Caâu 1:Ta coù coâng thöùc nhaåm nhanh: 22
2
CO CO
() HO
Vn2x 3y 11
V n 3x 4y 15
+
=
==
+
hôi
(*)
Vôùi x,y (mol) laàn löôït laø soá mol cuûa etan vaø propan.
Töø (*) deã daøng suy ñöôïc: x:y=1:3
⇒ Ñaùp aùn: c
Caâu 2: Kim loaïi coù tính chaát chung laø tính khöû
Ñaùp aùn: d
⇒
Caâu 3: Zn phaûn öùng ñöôïc vôùi caùc ion kim loaïi loaïi ñöùng sau Zn
Ñaùp aùn: c
⇒
Caâu 4: Deã thaáy d laø ñaùp aùn hôïp lí nhaát
Caâu 5: Fe + ZnO
⎯
⎯→ Khoâng phaûn öùng
Caùc phaûn öùng coøn laïi xaûy ra ñöôïc
⇒ Ñaùp aùn: b
Caâu 6: Cu + CuSO4
⎯
⎯→ Khoâng phaûn öùng
- Duøng nhoâm thì seõ bò laãn Al2(SO4)3
⇒ Ñaùp aùn: C (Duøng Fe ñaåy Cu roài loïc)
Caâu 7: Theo ñeà coù: Zn + Co2+
⎯
⎯→ Co + Zn2+
2
Z
n+
⇒/Zn < Co2+/Co
Coøn Pb + Co2+
⎯
⎯→ Khoâng phaûn öùng
Co2+/Co < Pb2+/Pb ⇒
Vaäy thöù töï hôïp lí: a
Caâu 8: Deã thaáy ñaùp aùn ñuùng laø: a
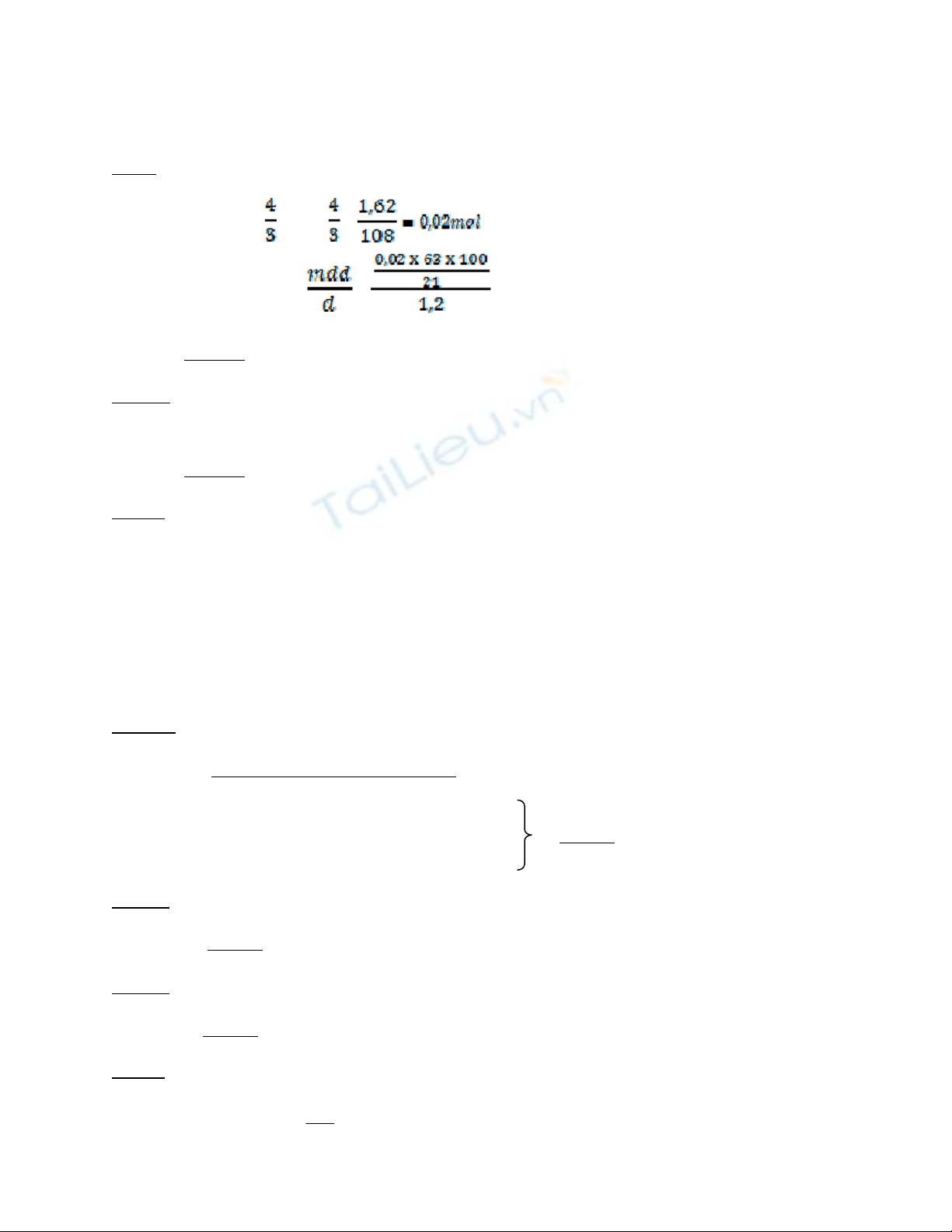
Caâu 9: 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O (1)
(1) => n HNO3 = nAg = x
⇒ VddHNO3 cần = = = 5(ml)
⇒ Ñaùp aùn: b
Caâu 10: Vì => Số H = 4 số C
=> Rượu: CH3OH
2
HO CO
n2n=
2
⇒ Ñaùp aùn: d
Caâu 11: Ta coù ptñp:
⎯⎯⎯⎯⎯→
ñp dd
2NaCl + CuSO Cu+ Cl + Na SO (1)
(Ctrô,mn)
4224
- Sau (1) coøn NaCl: neáu ñieän phaân tieáp seõ thu ñöôïc dd coù NaOH
- Sau (1) coøn CuSO4: Neáu ñieän phaân tieáp seõ thu ñöôïc H2SO4
- Al2O3 tan trong NaOH vaø H2SO4
⇒ Ñaùp aùn: d
Caâu 12:
-Ñoái vôùi phaûn öùng nhieät luyeän:
• MgO, Al2O3: khoâng phaûn öùng .
⇒ Ñaùp aùn: b
• Hieäu suaát pöù ñaït 100%, H2 dö
Caâu 13: Ta coù pöù : Cu + 2 AgNO3→ Cu(NO3)2 +2Ag (1)
⇒ Ñaùp aùn: a
Caâu 14: Do nhoùm(- NH2) laø nhoùm ñaåy e, neân laøm taêng maät ñoä e treân nhaân benzen.
⇒ Ñaùp aùn: a
Caâu 15: Töø ñeà baøi ta coù khoái löôïng AgNO3 pöù baèng: 4 g
3
AgNO
17
m4
100
⇒=×=giaûm 0,68g

⇒ Khoái löôïng vaät baèng ñoàng taêng 0,68 gam
m0,⇒Vaät taên 68g
g
⇒ Ñaùp aùn: d
Caâu 16: Ta coù pöù:
4 NO2 + 2 Ba(OH)2 → Ba(NO3)2 + Ba(NO2)2 +2 H2O (1)
2a mol a mol
(1) suy ra ñöôïc pöù vuøa ñuû ⇒ dd sau: chöùa Ba(NO3)2 , Ba(NO2)2
⇒ Ñaùp aùn: a ( MT bazô laøm dd phenolphtaleâin töø khoâng maøu hoaù thaønh ñoû)
Caâu 17: :
FeS2 -11e → Fe3+ + 2SO2 (1)
x 11x 2x (mol)
Cu2S - 8e → 2Cu2+ + SO2 (2)
y 8y y (mol)
SO4
2- + 2e SO2 (3)
2[0,2-(2x+y)] [0,2-(2x+y)]
(10, (2), (3) vaø ÑLBTÑT ta coù heä phöông trình:
120x + 160y = 4 x = 0,02
11x + 8y = 2[0,2-(2x+y)] y = 0,01
Câu 18: [H2SO4] = = 0,9
⇒
⇒ Ñaùp aùn : a
⇒ Ñaùp aùn
: b
Câu 19: nHCl = 0,025mol; nAgNO3 > 0,025mol
C
% ddHNO3 = . 100 = 3%
⇒ Ñaùp aùn : c
Ñaùp aùn : d
Câu 20: Dễ thấy
Câu 21: Cu: xmol
Theo đề ta có:
Fe: ymol
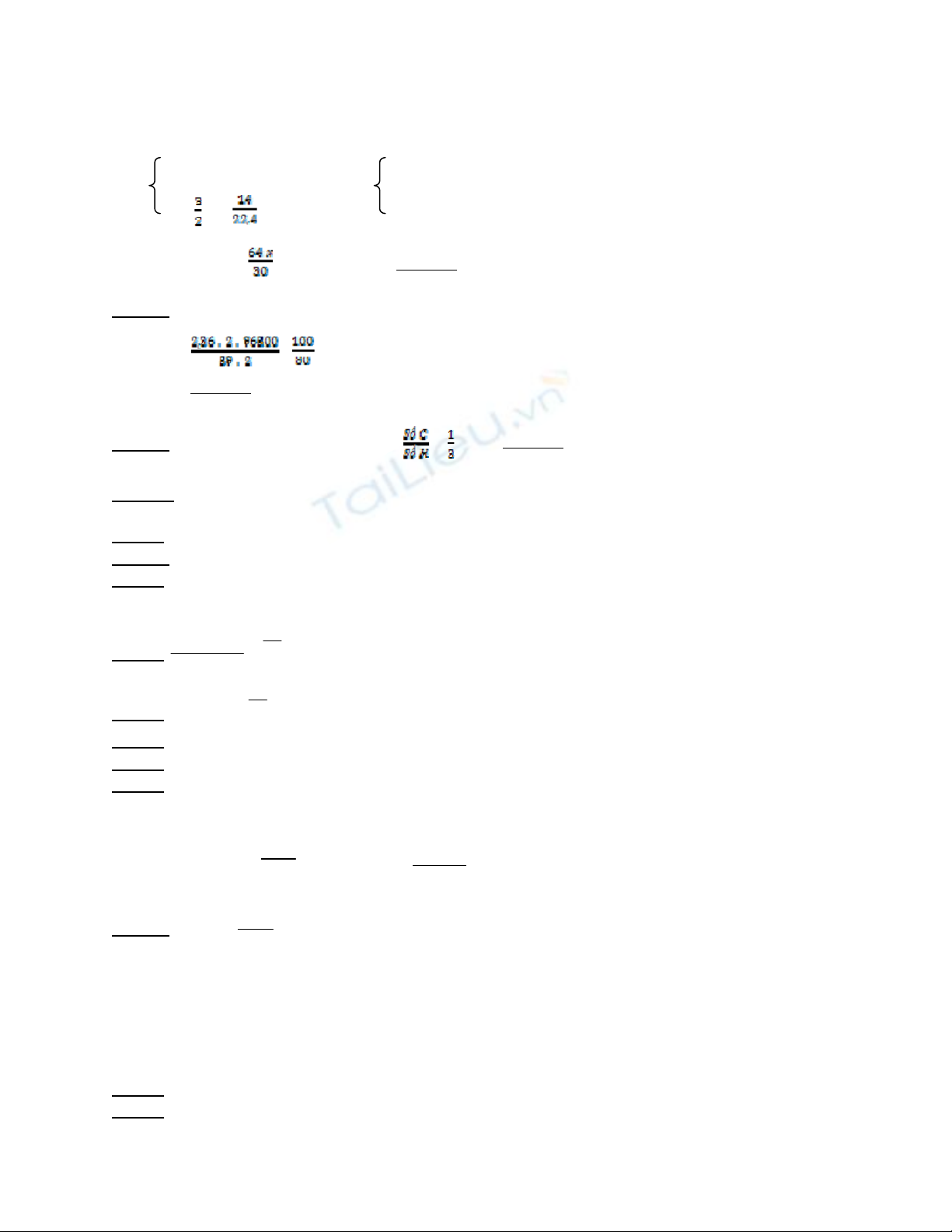
64x + 56y = 30 x = 0,25
=>
x +
y = y = 0,25
Ö %Cu = .100 = 53,33 ⇒ Ñaùp aùn
Câu 22: Ta có
t = . = 4825 (giây)
Câu 23: a, c không có hydrôcacbon có =
: c
⇒ Ñaùp aùn
⇒ Ñaùp aùn : b
: b
Câu 24: Deã thaáy ñaùp aùn c laù hôïp lyù.
Câu 25: Choïn b
Câu 26: Choïn a
Câu 27: OÁng CuO giaûm laø mO2 pöù => ÑLBTKL 1,2 + 1,28 = m H2O + 1,76
=> mH2O = 0,72g. Choïn a
45 90
2
AB
AB
MM MMM
+==⇒ + =
Câu 28 CH3OH vaø C3H5OH. Choïn d
Câu 29: CH3OH < 37
41,33
M
CHOH=< . CHoïn b
Câu 30: Röôïu laø CH3OH → andehitHCHO. Choïn b
Câu 31: Choïn c
Câu 32:HCOOH + NaOH → HCOONa + ROH
0,14 → 0,14 (mol )
=> ROH = 8, 4 60
0,14
= C3H7OH. Choïn c
Câu 33: mol A = 3, 52 0, 04
88 mol=
mol NaOH dö = 0,02 => 0,04 (RCOONa) + 0,02 x 40 = 4,08
RCOONa = 82 CH3COONa
=> A laø CH3COOC2H5. Choïn d
Câu 34:Choïn b A: CH3COOCH3 vaø B CH3COOH
Câu 35:Töø 25 ñeán 100oC taêng 75% = 3x 25
Vaäy vaän toác taêng 33 =27 laàn choïn ñaùp aùn c

Câu 36:H2SO4 → SO4
2- + H2
0,06 0,06
M raén = 1,9+ m SO42- = 7,66g. Choïn ñaùp aùn
Câu 37:Kim loaïi
X
+ n H+ → 2
nH2
x 4
2
x
= 0,15 => nx=0,3
x – 1e N+5 + 3e → NO
x n x nx → 3
nx =0,1
=> V (NO) = 2,24 (l) choïn a
Câu 38:CO + O → CO2 => mol CO2 = mol CaCO3 = 0,16
m tröôùc = m sau + 16. 0,16 = 16,7g choïn c
Câu 39:mol Al = 0, 54 0, 02
27
=
mol H+ = 0,08 ta coù Al + 3H+ → Al3+ + 3
2H2
0,02 0,06 0,02
Dd Y (H+ dö 0,02; Al3+ 0,02)
H
+ + OH- → H2O
0,02 0,02
Al3+ + 3OH- → Al(OH)3
mol OH- = 0,08mol => V= 0, 08
2 = 0,04 (l) choïn a
Câu 40:pH = 12 => pOH = 2 => [OH]- =10-2
mol OH- = 10-2 v1
pH = 2 => [H+] =10-2 => mol H+ = v2. 10-2 => v1 = v2 choïn a
GV. Nguyễn Tấn Trung
TT luyện thi Đại học CLC Vĩnh Viễn



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

