Hiđrô clorua
Hiđrô clorua
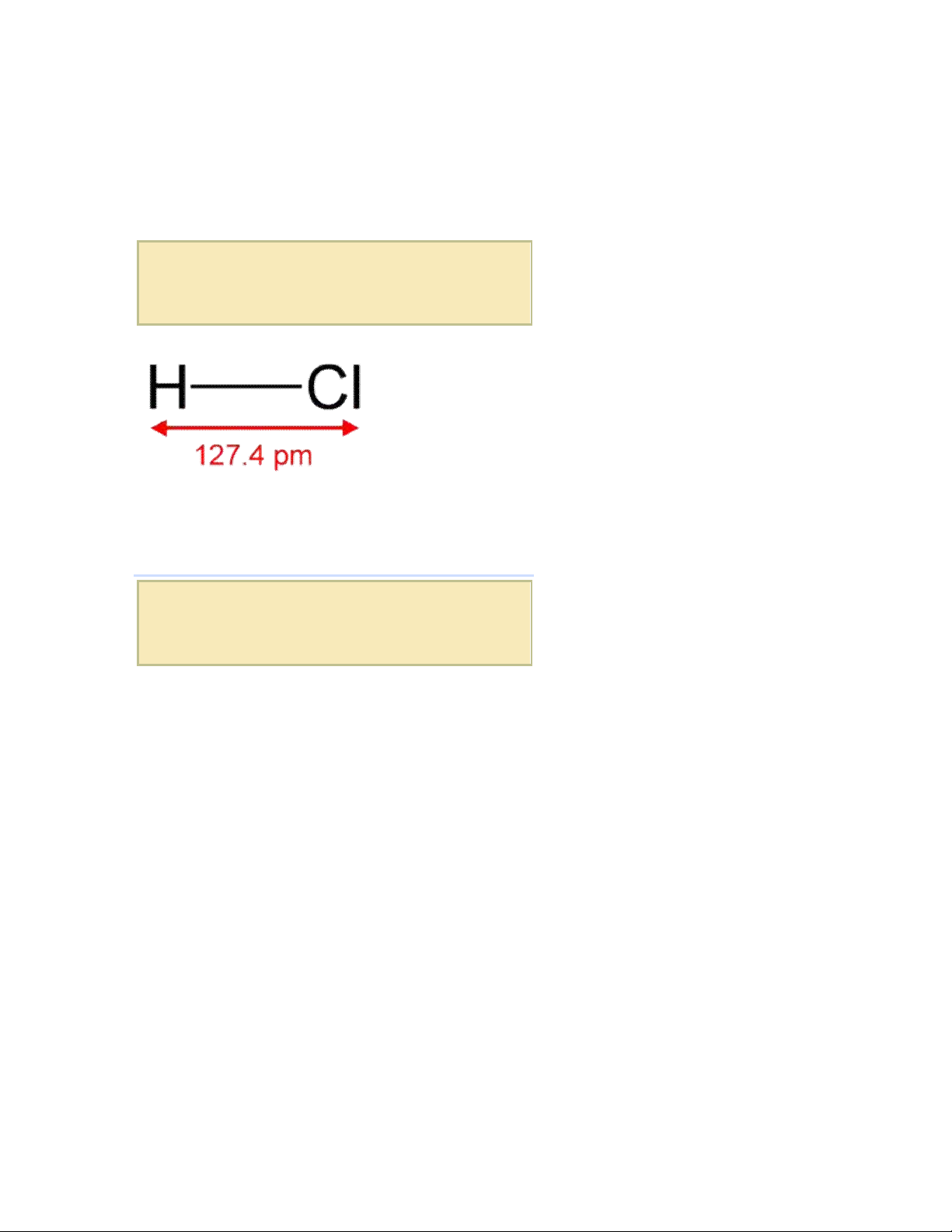
Cấu trúc phân tử của hiđrô clorua
Tổng quan
Danh pháp IUPAC Hiđrô clorua
Cloran
Tên khác
Axít clohiđric
Clorua hiđrô
Axít hiđrocloric
Khí axít hiđrocloric
Công thức phân tử HCl (khí)

Phân tử gam 36,4606 g/mol
Biểu hiện Khí không màu, ưa ẩm
Số CAS [7747-01-0]
Thuộc tính
Tỷ trọng và pha 1,477 g/L
Độ hòa tan trong nước
720g/L (20°C)
Điểm nóng chảy -114,2 °C (158,8 K)
Điểm sôi -85,1 °C (187,9 K)
pKa -4
pKb
Độ nhớt
Nguy hiểm
MSDS MSDS ngoài
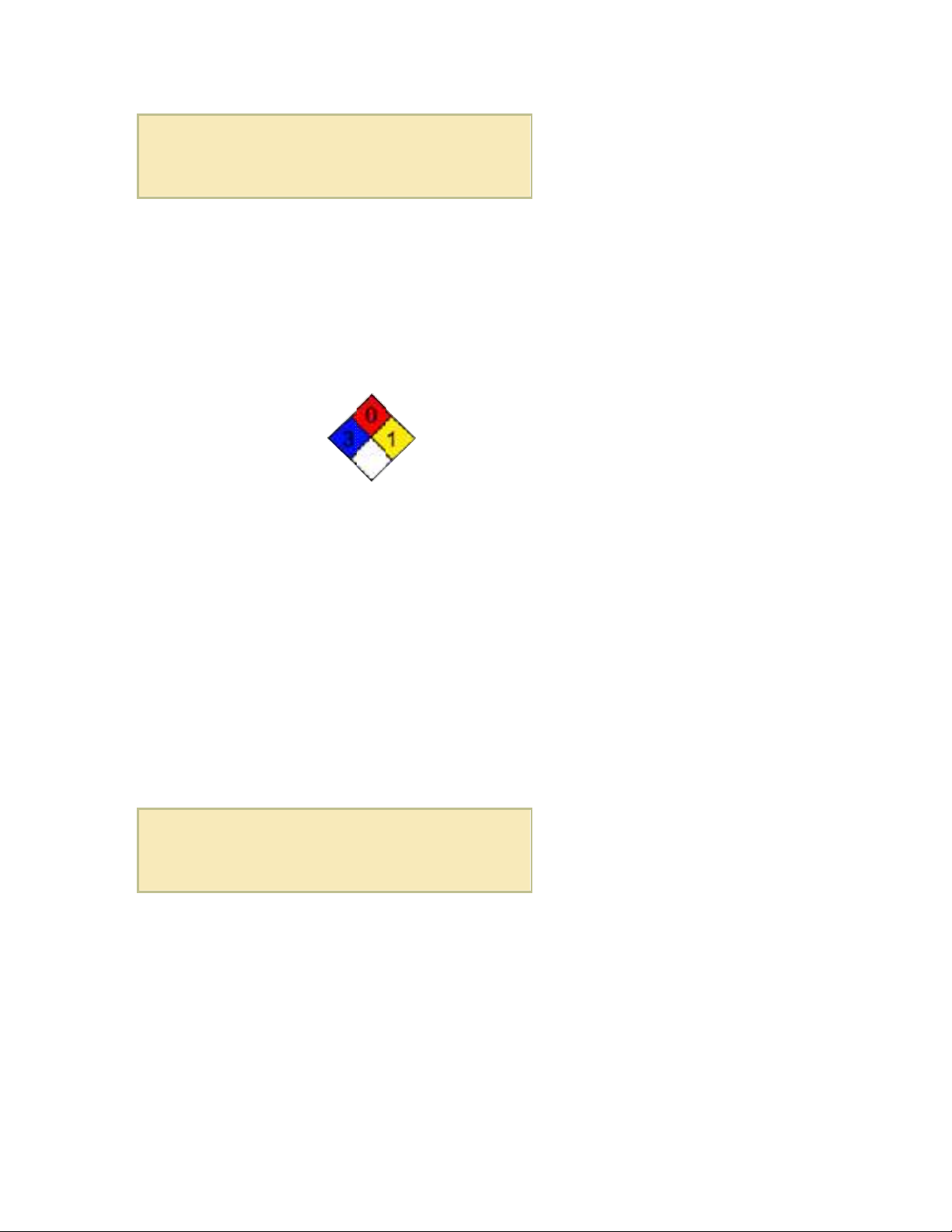
Các nguy hiểm chính Độc hại, chất ăn mòn
NFPA 704
Điểm bắt lửa Không cháy
Rủi ro/An toàn R: 23, 24, 25, 35, 37
S: 7, 9, 26, 36, 37, 39, 45
Số RTECS MW4025000
Trang dữ liệu bổ sung
Cấu trúc & thuộc tính n εr, v.v.
Dữ liệu nhiệt động lực
Các trạng thái
rắn, lỏng, khí

Dữ liệu quang phổ UV, IR, NMR, MS
Các hợp chất liên quan
Các hợp chất tương tự
HF
HBr
HI
Các hợp chất liên quan
Axít clohiđric
Ngoại trừ có thông báo khác, các dữ liệu
được lấy ở 25°C, 100 kPa
Thông tin về sự phủ nhận và tham chiếu
Hợp chất hóa học Hiđrô clorua HCl, là một chất khí không màu, độc hại, có tính
ăn mòn cao, tạo thành khói trắng khi tiếp xúc với hơi ẩm. Hơi trắng này là axít
clohiđric được tạo thành khi hiđrô clorua hòa tan trong nước. Hiđrô clorua cũng
như axít clohiđric là các hóa chất quan trọng trong công nghiệp hóa chất, khoa
học, công nghệ. Tên gọi HCl thông thường hay được dùng để chỉ (ở một mức độ
nào đó là không hoàn toàn chính xác) axít clohiđric thay vì để chỉ hiđrô clorua ở
trạng thái khí.
Hóa học
Phân tử hiđrô clorua (HCl) là một phân tử hai nguyên tử đơn giản, bao gồm một
nguyên tử hiđrô và một nguyên tử clo kết hợp với nhau thông qua một liên kết đơn

cộng hóa trị. Do nguyên tử clo có độ âm điện cao hơn so với nguyên tử hiđrô nên
liên kết cộng hóa trị này là phân cực rõ ràng. Do phân tử tổng thể có mômen lưỡng
cực lớn với điện tích một phần âm δ- tại nguyên tử clo và điện tích dương δ+ tại
nguyên tử hiđrô, nên phân tử hai nguyên tử hiđrô clorua là phân tử phân cực
mạnh. VÌ thế, nó rất dễ dàng hòa tan trong nước cũng như trong các dung môi
phân cực khác.
Khi tiếp xúc với nước, nó nhanh chóng bị ion hóa, tạo thành các cation hiđrô
(H3O+) và các anion clorua (Cl-) thông qua phản ứng hóa học thuận nghịch sau:
HCl + H2O → H3O+ + Cl−
Dung dịch tạo thành được gọi là axít clohiđric và nó là một axít mạnh. Hằng số
điện li axít hay hằng số ion hóa Ka là rất lớn, nghĩa là HCl bị điện li hay ion hóa
toàn phần trong nước.
Kể cả khi không có mặt nước thì hiđrô clorua vẫn có thể có phản ứng như một
axít. Ví dụ, hiđrô clorua có thể hòa tan trong các dung môi phân cực khác như
mêtanol và có phản ứng như một chất xúc tác axít cho các phản ứng hóa học khi
điều kiện khan nước (anhiđrơ) là mong muốn.
HCl + CH3OH → CH3O+H2 + Cl−
HCl cung cấp proton cho phân tử mêtanol (CH3OH)
Do bản chất axít của nó, hiđrô clorua là một chất khí có tính ăn mòn, cụ thể là khi
có sự hiện diện của hơi ẩm.





![Lý thuyết cơ bản Đại cương kim loại Hóa học lớp 12 [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111004/ntzthanh/135x160/hoa_hoc_lop_12_ly_thuyet_co_ban_ve_dai_cuong_kim_loai_1103.jpg)



![Hiđrô Perôxít: [Thêm mô tả/ứng dụng/cách dùng nếu có]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20110120/nuockhoangthiennhien/135x160/hoa_hoc_120_387.jpg)
















