
Hóa h c đ i c ng 1 Gi ng viên: Ths Nguy n Vănọ ạ ươ ả ễ
Quang
CH NG I: CÁC KHÁI NI M. Đ NH LU T C B NƯƠ Ệ Ị Ậ Ơ Ả
5 ( 2, 3 )
Ngày so n: 5/9/2010ạ
Ngày gi ng: 11/10/2010 -15/10/2010ả
I. M c tiêu bài gi ng ụ ả
1. Ki n th cế ứ
Sau khi h c ch ng này sinh viên c n n m đ c: ọ ươ ầ ắ ượ
- Các khái ni m hoá h c c b n: ch t, đ n ch t, h p ch t, nguyên t , phân t ,ệ ọ ơ ả ấ ơ ấ ợ ấ ử ử
nguyên t kh i, phân t kh i, mol phân t , mol nguyên tử ố ử ố ử ử
- H đ n v .ệ ơ ị
- M t s đ nh lu t c b n c a hoá h c: đ nh lu t b o toàn kh i l ng, b o toànộ ố ị ậ ơ ả ủ ọ ị ậ ả ố ượ ả
nguyên t , đ nh lu t thành ph n không đ i, đ nh lu t Avogađro..ố ị ậ ầ ổ ị ậ
- Công th c hoá h c, ph ng trình hoá h c…ứ ọ ươ ọ
2. Kĩ năng
- Vi t công th c hoá h c, thi t l p ph ng trình hoá h cế ứ ọ ế ậ ươ ọ
- Tính toán theo ph ng trình hoá h cươ ọ
- Đ i đ n v trong các h đ n vổ ơ ị ệ ơ ị
- S d ng các đ nh lu t đ làm bài t pử ụ ị ậ ể ậ
3. Tình c m, thái đả ộ
Lòng yêu thích b môn hoá h cộ ọ
II. Ph ng pháp gi ng d yươ ả ạ
- Đàm tho i ôn t p c ng c ( ki n th c trong ch ng ch y u là cũ )ạ ậ ủ ố ế ứ ươ ủ ế
-Làm bài t pậ
-Ph ng pháp thuy t trìnhươ ế
III. Chu n bẩ ị
-GV: giáo án, giáo trình
-SV: Giáo trình, bài chu n bẩ ị
IV. N i dung gi ng d yộ ả ạ
Khoa T nhiênự - Tr ng Cao đ ng S ph m Qu ng Ninhườ ẳ ư ạ ả
Hóa h c đ i c ng 1 Gi ng viên: Ths Nguy n Vănọ ạ ươ ả ễ
Quang
Ho t đ ng c a GV và SVạ ộ ủ N i dung bài d yộ ạ
Ho t đ ngạ ộ : khái ni m, c u t oệ ấ ạ
nguyên tử
- SV cho bi t khái ni m nguyênế ệ
tử
- GV: hãy nêu c u t o nguyên tấ ạ ử
- SV: nguyên t g m l p v vàử ồ ớ ỏ
h t nhânạ
- SV nêu đ c tính c a các lo iặ ủ ạ
h t c u t o nên nguyên tạ ấ ạ ử
VD:
- S l ng các lo i h t có trong:ố ượ ạ ạ
Na, Na+, Cl, Cl-, H2O
Ho t đ ngạ ộ : Nguyên t hoáố
h c.ọ
- SV nêu khái ni m nguyên tệ ố
hoá h cọ
- Trong các kí hi u sau nh ng kíệ ữ
hi u nào là cùng m t nguyên tệ ộ ố
hoá h cọ
818X, 817Y, 918Z, 716L
Ho t đ ng:ạ ộ Đ ng vồ ị
- GV: khái ni m đ ng v ?ệ ồ ị
- Oxi có 3 đ ng v : ồ ị 16O, 17O, 18O;
Hidro có 2 đ ng v ồ ị 1H, 2H
a. Có bao nhiêu lo i phân tạ ử
n c đ c t o ra t các lo iướ ượ ạ ừ ạ
đ ng v trên.ồ ị
b. Tính kh i l ng phân tố ượ ử
c a các lo i n c đóủ ạ ướ
Ho t đ ng:ạ ộ Ch tấ
- GV: Ch t có đâu.ấ ở
- SV: Ch t có m i n i: n c,ấ ở ọ ơ ướ
khí oxi, s t…ắ
- GV: th nào là đ n ch t, h pế ơ ấ ợ
ch tấ
- Đ n ch t …ơ ấ
Bài 1: CÁC KHÁI NI M C B NỆ Ơ Ả
I. Nguyên tử
1. Khái ni mệ
Nguyên t là h t nh nh t c a nguyên t hoá h c không thử ạ ỏ ấ ủ ố ọ ể
phân chia v m t hoá h cề ặ ọ
2. C u t oấ ạ
- Nguyên t c u t o t 3 lo i h t: electron, proton, n tron.ử ấ ạ ừ ạ ạ ơ
- V : e mang đi n tích âmỏ ệ
- H t nhân: proton và n tron, proton mang đi n tích d ng ạ ơ ệ ươ
- Đ c đi m c a các lo i h t:ặ ể ủ ạ ạ
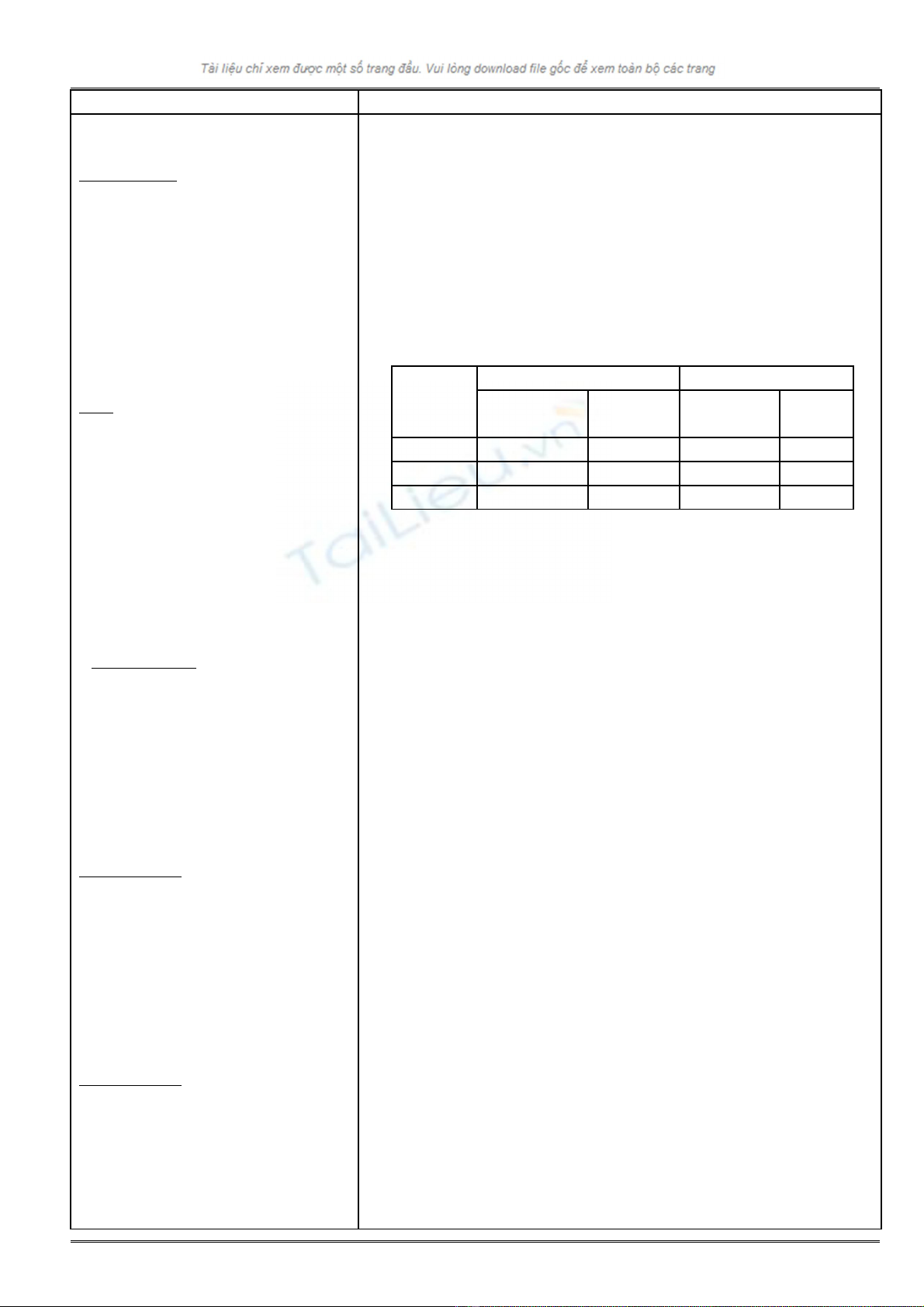
Kh i l ngố ượ Đi n tíchệ
kg u C Quy
cướ
Electron 9,1.10-31 5,55.10-4 -1,6.10-19 -1
Proton 1.67.10-27 1 1,6.10-19 +1
Notron 1.67.10-27 1 0 0
- Trong nguyên t t ng s đi n tích âm và d ng b ng nhau.ử ổ ố ệ ươ ằ
Nguyên t trung hoà v đi nử ề ệ
II. Nguyên t hoá h cố ọ
1. Khái ni mệ
Nguyên t hoá h c là nh ng nguyên t có cùng đi n tích h tố ọ ữ ử ệ ạ
nhân
2. Kí hi u nguyên t hoá h cệ ố ọ
- S đ n v đi n tích h t nhân c a m t nguyên t đ c g i làố ơ ị ệ ạ ủ ộ ố ượ ọ
s hi u nguyên t c a nguyên t đó. Kí hi u là Z.ố ệ ử ủ ố ệ
- S kh i A = Z + N = N + Pố ố
- Kí hi u nguyên t : ệ ố AZX
III. Đ ng vồ ị
- Các đ ng v c a cùng m t nguyên t hoá h c là nh ngồ ị ủ ộ ố ọ ữ
nguyên t có cùng s proton nh ng khác nhau s n tron, doử ố ư ố ơ
đó s kh i A c a chúng khác nhau.ố ố ủ
- VD: oxi có 3 đ ng v ồ ị 816O, 817O, 819O
IV. Ch t. Đ n ch t, h p ch t. Phân tấ ơ ấ ợ ấ ử
1. Ch tấ
- Ch t là t p h p các ti u phân có thành ph n c u t o, tínhấ ậ ợ ể ầ ấ ạ
ch t xác đ nh và có th t n t i đ c l p trong nh ng đi uấ ị ể ồ ạ ộ ậ ữ ề
ki n nh t đ nh.ệ ấ ị
- Ch t mà phân t đ c c u t o t m t lo i nguyên t thìấ ử ượ ấ ạ ừ ộ ạ ử
g i là đ n ch t.ọ ơ ấ
VD: Ag, O2, H2
Khoa T nhiênự - Tr ng Cao đ ng S ph m Qu ng Ninhườ ẳ ư ạ ả
Hóa h c đ i c ng 1 Gi ng viên: Ths Nguy n Vănọ ạ ươ ả ễ
Quang
VD: trong các ch t sau đâu làấ
đ n ch t, h p ch t: Hơ ấ ợ ấ 2O, CO2,
O2, H2SO4, H2, Cu, C2H6, Au?
Ho t đ ngạ ộ : nghiên c u kháiứ
ni m phân tệ ử
- GV: khái ni m phân t ?ệ ử
- Thành ph n phân t ?ầ ử
+ Phân t có th đ c t o t 1ử ể ượ ạ ừ
nguyên t : phân t đ n nguyênử ử ơ
tử
+ Phân t t o ra t 2 nguyên tử ạ ừ ử
tr lên: phân t nhi u nguyên tở ử ề ử
- GV: Các lo i liên k t trongạ ế
phân t , đ c đi m các lo i liênử ặ ể ạ
k t.ế
Ho t đ ngạ ộ : h đ n vệ ơ ị
VD: Hãy bi u th m i s li uể ị ỗ ố ệ
sau đây theo đ n v c b n c aơ ị ơ ả ủ
h SI t ng ng:ệ ươ ứ
a. Đ dài trung bình c a m tộ ủ ộ
liên k t là 149,5 pmế
b. M t m nh thiên th ch n ngộ ả ạ ặ
0,5 Gkg
c. Th i gian s ng trung bình c aờ ố ủ
m t vi h t vào kho ng 0,5 nsộ ạ ả
d. L ng m t nguyên t m iượ ộ ố ớ
đi u ch đ c vào kho ng 0,5ề ế ượ ả
pmol
Ho t đ ng:ạ ộ mol, kh i l ngố ượ
mol
- Khái niêm mol, mol nguyên t ,ử
mol phân t ?ử
- Ch t mà phân t đ c c u t o t hai lo i nguyên t tr lênấ ử ượ ấ ạ ừ ạ ử ở
đ c g i là h p ch tượ ọ ợ ấ
VD: N c Hướ 2O, khí cacbonic CO2
- Đ n ch t chia làm 2 lo i: kim lo i và phi kimơ ấ ạ ạ
- H p ch t: vô c , h u cợ ấ ơ ữ ơ
2. Phân tử
a. Khái ni mệ
Phân t là h t đ i di n cho ch t, g m m t s nguyên t liênử ạ ạ ệ ấ ồ ộ ố ử
k t v i nhau và th hi n đ y đ tính ch t hoá h c c a ch t.ế ớ ể ệ ầ ủ ấ ọ ủ ấ
b. Thành ph n phân tầ ử
- Phân t đ c t o ra t các h t nh h n: nguyên t hay ionử ượ ạ ừ ạ ỏ ơ ử
- Phân t có th đ c t o t 1 nguyên t : phân t đ nử ể ượ ạ ừ ử ử ơ
nguyên tử
- Phân t t o ra t 2 nguyên t tr lên: phân t nhi u nguyênử ạ ừ ử ở ử ề
tử
- Liên k t t o thành phân t (liên k t hoá h c)ế ạ ử ế ọ
+ Liên k t c ng hoá tr : b ng c p e dùng chungế ộ ị ằ ặ
+ Liên k t ion: b ng l c hút tĩnh đi nế ằ ự ệ
c. S l c v t ng tác phân tơ ượ ề ươ ử
- Gi a các phân t t n t i liên k t phân tữ ử ồ ạ ế ử
- L c t ng tác gi a các phân t th ng y uự ươ ữ ử ườ ế
d. M t s đ c đi m v phân tộ ố ặ ể ề ử
- Kh i l ng phân tố ượ ử
- Đi n tích phân t : trung hoà (=0)ệ ử
- C u t o: các ch t có cùng công th c phân t nh ng khácấ ạ ấ ứ ử ư
nhau v công th c c u t o nên có tính ch t khác nhauề ứ ấ ạ ấ
- Tính ch tấ
V. H đ n v . H SIệ ơ ị ệ
- M t l ng v t ch t đ c ch b ng tr s kèm theo đ n vộ ượ ậ ấ ượ ỉ ằ ị ố ơ ị
L ng v t ch t = Tr s . đ n vượ ậ ấ ị ố ơ ị
- H đ n v : h SI và h đ n v theo thói quenệ ơ ị ệ ệ ơ ị
- H SI ( qu c t )ệ ố ế
1. H SI c s ( M c l c)ệ ơ ở ụ ụ
2. Đ n v d n xu t t đ n v c s (M c l c)ơ ị ẫ ấ ừ ơ ị ơ ở ụ ụ
VI. Mol. Kh i l ng molố ượ
1. Mol
- Mol là l ng ch t ch a 6.10ượ ấ ứ 23 hat vi mô
- Mol nguyên t là l ng ch t ch a 6.10ử ượ ấ ứ 23 nguyên t c a ch tử ủ ấ
đó
- Mol phân t là l ng ch t ch a 6.10ử ượ ấ ứ 23 phân t c a ch t đóử ủ ấ
Khoa T nhiênự - Tr ng Cao đ ng S ph m Qu ng Ninhườ ẳ ư ạ ả

Hóa h c đ i c ng 1 Gi ng viên: Ths Nguy n Vănọ ạ ươ ả ễ
Quang
- Kh i l ng mol?ố ượ
VD: Hãy xác đ nh đ ng l ngị ươ ượ
c a clo, oxi , nit trong các h pủ ơ ợ
ch t sau: HCl, Hấ2O, NH3
ĐCl = 35,5/1 = 35,5
ĐO = 16/2 = 8
ĐN = 14/3 = 4,67
VD: Xác đ nh đ ng l ng c aị ươ ượ ủ
l u huỳnh trong SOư2, SO3? Nh nậ
xét gì?
Gi i: ả
SO2. ĐS= 32/4= 8
SO3, ĐS= 32/6=5,33
=> L u huỳnh 2 công th c cóư ở ứ
2 giá tr đ ng l ngị ươ ượ
=> M t nguyên t hoá h c cóộ ố ọ
th có nhi u giá tr đ ng l ngể ề ị ươ ượ
tuỳ thu c vào h p ch t xétộ ợ ấ
BT:
Tìm đ ng l ng c a:ươ ượ ủ
a. Cl trong m i h p ch t sauỗ ợ ấ
đây: HCl, KClO3, HClO4
b. NaOH, Ca(OH)2, H3PO4
c. HCl, H2SO4, H3PO4
d. NaNO3, Na2SO4, CaSO4,
K3PO4, Ca3(PO4)2
Ho t đ ngạ ộ : m t s đ nh lu t cộ ố ị ậ ơ
b nả
- GV: SV nêu m t s đ nh lu tộ ố ị ậ
2. Kh i l ng molố ượ
- Kh i l ng mol c a ch t là kh i l ng tính b ng đ n vố ượ ủ ấ ố ượ ằ ơ ị
cacbon c a N h t vi môủ ạ
- Kh i l ng mol nguyên t (nguyên t kh i): kh i l ngố ượ ử ử ố ố ượ
tính b ng đ n v cácbon c a N nguyên tằ ơ ị ủ ử
- Phân t kh i: kh i l ng tính b ng đ n v cacbon c a Nử ố ố ượ ằ ơ ị ủ
phân tử
VII. Đ ng l ngươ ượ
1. Đ ng l ng c a m t nguyên tươ ượ ủ ộ ố
- Khái ni m: đ ng l ng c a m t nguyên t là ph n kh iệ ươ ượ ủ ộ ố ầ ố
l ng c a nguyên t đó k t h p v i 1,008 ph n kh i l ngượ ủ ố ế ợ ớ ầ ố ượ
c a hiđro ho c 8 ph n kh i l ng oxi, ho c thay th m iủ ặ ầ ố ượ ặ ế ỗ
l ng trên trong các h p ch tượ ợ ấ
- H qu : Đ ng l ng c a m t nguyên t là l ng nguyênệ ả ươ ượ ủ ộ ố ượ
t t ng ng v i đ n v hoá tr c a nguyên t đó.ố ươ ứ ớ ơ ị ị ủ ố
Đ = A/n
Đ: Đ ng l ng c a nguyên tươ ượ ủ ố
A: Kh i l ng nguyên tố ượ ử
n: Hoá tr c a nguyên tị ủ ố
- Khi nói đ ng l ng c a m t nguyên t ph i g n v i h pươ ượ ủ ộ ố ả ắ ớ ợ
ch t nào đóấ
2. Đ ng l ng c a m t h p ch tươ ượ ủ ộ ợ ấ
- Đ ng l ng c a m t h p ch t là kh i l ng h p ch t đóươ ượ ủ ộ ợ ấ ố ượ ợ ấ
tác d ng v a đ v i m t đ ng l ng c a ch t khácụ ừ ủ ơ ộ ươ ượ ủ ấ
- Quy t c kinh nghi m:ắ ệ
+ Đ ng l ng c a m t oxit kim lo i b ng kh i l ng phânươ ượ ủ ộ ạ ằ ố ượ
t c a oxit chia cho tích hoá tr kim lo i v i s nguyên t kimử ủ ị ạ ớ ố ử
lo i trong công th c oxit đóạ ứ
+ Đ ng l ng c a m t axit b ng kh i l ng c a phân tươ ượ ủ ộ ằ ố ượ ủ ử
c a axit chia cho s nguyên t hidro đ c thay th trong phânủ ố ử ượ ế
t axit đó.ử
+ Đ ng l ng c a m t baz : Kh i l ng phân t chia choươ ượ ủ ộ ơ ố ượ ử
s nhóm OH ( ho c hoá tr kim lo i)ố ặ ị ạ
+ Đ ng l ng c a mu i b ng kh i l ng phân t chia choươ ượ ủ ố ằ ố ượ ử
t ng đi n tích c a các cation ( hay anion)ổ ệ ủ
+ Đ ng l ng c a m t ch t trong ph n ng oxi hoá- khươ ượ ủ ộ ấ ả ứ ử
b ng kh i l ng phân t chia s e trao đ iằ ố ượ ử ố ổ
3. Đ ng l ng gamươ ượ
- Đ ng l ng gam c a m t ch t là l ng ch t đó bi u thươ ượ ủ ộ ấ ượ ấ ể ị
theo gam có tr s b ng tr s đ ng l ng c a ch t đóị ố ằ ị ố ươ ượ ủ ấ
Bài 2: M T S Đ NH LU T C B NỘ Ố Ị Ậ Ơ Ả
I. Đ nh lu t b o toàn kh i l ngị ậ ả ố ượ
- T ng kh i l ng các ch t tham gia ph n ng b ng t ngổ ố ượ ấ ả ứ ằ ổ
kh i l ng các ch t thu đ c sau ph n ng.ố ượ ấ ượ ả ứ
Hay : có s b o toàn v t ch t trong ph n ng hoá h cự ả ậ ấ ả ứ ọ
II. Đ nh lu t đ ng l ngị ậ ươ ượ
Khoa T nhiênự - Tr ng Cao đ ng S ph m Qu ng Ninhườ ẳ ư ạ ả

Hóa h c đ i c ng 1 Gi ng viên: Ths Nguy n Vănọ ạ ươ ả ễ
Quang
c b n?ơ ả
- Đ nh lu t b o toàn kh i l ng,ị ậ ả ố ượ
đ nh lu t thành ph n không đ i,ị ậ ầ ổ
đ nh lu t Avôgađroị ậ
VD: Thay d u ? trong các ph nấ ả
ng sau và cân b ngứ ằ
a. ? + H2SO4 -> Al2(SO4)3 + H2
b. CaCl2 + H3PO4 -> ? + HCl
- Nêu đ nh lu t và l y ví d .ị ậ ấ ụ
- Đ nh lu t Avôgadro, vi t bi uị ậ ế ể
th c?ứ
+ đktc: V= 22,4.n
- Ph ng trình tr ng thái khí líươ ạ
t ng.ưở
Ho t đ ng:ạ ộ PP xác đ nh kh iị ố
l ng mol phân t d a vào tượ ử ự ỉ
kh i h iố ơ
- Đ a ra công th c tính kh iư ứ ố
l ng riêngượ
VD: Tìm kh i l ng riêng c aố ượ ủ
khí F2 1atm và 25ở0C
BT: M t l ng h i c a ch t Xộ ượ ơ ủ ấ
n ng h n l ng khí Nặ ơ ượ 2 ( cùng
đk) g p 2 l n. Hãy xác đ nh:ấ ầ ị
- Tính KLPT c a Mủ
- Kh i l ng riêng c a X t i 1ố ượ ủ ạ
atm, 250C. Bi t N= 14.ế
- Các nguyên t k t h p v i nhau hay thay th cho nhauố ế ợ ớ ế
(trong ph n ng hoá h c) theo các kh i l ng t l v iả ứ ọ ố ượ ỉ ệ ớ
đ ng l ng c a chúngươ ượ ủ
- Ph n ng hoá h c: s đ ng l ng các ch t b ng nhauả ứ ọ ố ươ ượ ấ ằ
VD: Ph n ng: HCl + NaOH ả ứ
→
NaCl + H2O
Có V1 lít dung d ch HCl Cị1 ph n ng v a đ v i Vả ứ ừ ủ ớ 2 lít dd
NaOH C2 ( C1, C2 : n ng đ đ ng l ng)ồ ộ ươ ượ
Có : V1.C1= V2.C2
III. Đ nh lu t thành ph n không đ iị ậ ầ ổ
- M t h p ch t hóa h c dù đ c đi u ch b ng cách nàoộ ợ ấ ọ ượ ề ế ằ
cũng đ u có thành ph n không đ i.ề ầ ổ
VD: N c có t l nguyên t H : O là 2:1, m c dù n c cóướ ỉ ệ ử ặ ướ
th t o ra theo nhi u cáchể ạ ề
2H2 + O2
→
2H2O
2NaOH + H2SO4
→
Na2SO4 + H2O
IV. Đ nh lu t t l b iị ậ ỉ ệ ộ
- N u hai nguyên t hoá h c t o v i nhau m t s h p ch tế ố ọ ạ ớ ộ ố ợ ấ
thì các l ng c a m t nguyên t (mà l ng đó) k t h p v iượ ủ ộ ố ượ ế ợ ớ
cùng m t l ng nguyên t kia t l v i nhau nh các sộ ượ ố ỉ ệ ớ ư ố
nguyên
V. Đ nh lu t Avôgađro. Th tích mol phân t ch t khíị ậ ể ử ấ
- nhi t đ gi ng nhau, áp su t gi ng nhau, nh ng th tíchỞ ệ ộ ố ấ ố ữ ể
b ng nhau c a các ch t khí b ng nhau đ u ch a s l ngằ ủ ấ ằ ề ứ ố ượ
phân t nh nhau.ử ư
- cùng nhi t đ và áp su t, th tích nh nhau c a m i ch tỞ ệ ộ ấ ể ư ủ ọ ấ
khí ch a cùng m t s mol khí.ứ ộ ố
- đi u ki n tiêu chu n (đktc) t =0Ở ề ệ ẩ 0C, P =1atm, 1 mol b t kìấ
ch t khí đ u chi m th tích 22,4 dmấ ề ế ể 3 (22,4 lít )
- Ph ng trình tr ng thái khí lí t ng: PV=nRTươ ạ ưở
Khí lí t ng; khí mà kích th c m i phân t đ c b quaưở ướ ỗ ử ượ ỏ
Bài 3. M T S PH NG PHÁP XÁC Đ NH Ộ Ố ƯƠ Ị
KH I L NG MOL PHÂN T C A CH T KHÍ Ố ƯỢ Ử Ủ Ấ
HAY CH T L NG D BAY H IẤ Ỏ Ễ Ơ
I. D a vào t kh i h iự ỉ ố ơ
1. Kh i l ng riêngố ượ
- Kh i l ng riêng c a m t đ n v th tích t i nhi t đ xácố ượ ủ ộ ơ ị ể ạ ệ ộ
đ nh, áp su t xác đ nh, đ c g i là kh i l ng riêng c a khíị ấ ị ượ ọ ố ượ ủ
đó
D = m/V
N u xét 1 mol khí đktc, ta có: D = M/22,4ế ở
2. T kh i h iỉ ố ơ
- T kh i h i c a khí A so v i khí B là t s kh i l ng riêngỉ ố ơ ủ ớ ỉ ố ố ượ
c a khí A so v i khí Bủ ớ
dA/B = DA/DB = MA/MB
II. D a vào ph ng trình tr ng thái khí lí t ngự ươ ạ ưở
PV= nRT mà n = m/M
=> M = nRT/PV
Khoa T nhiênự - Tr ng Cao đ ng S ph m Qu ng Ninhườ ẳ ư ạ ả





![Lý thuyết cơ bản Đại cương kim loại Hóa học lớp 12 [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111004/ntzthanh/135x160/hoa_hoc_lop_12_ly_thuyet_co_ban_ve_dai_cuong_kim_loai_1103.jpg)


![Hiđrô Perôxít: [Thêm mô tả/ứng dụng/cách dùng nếu có]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20110120/nuockhoangthiennhien/135x160/hoa_hoc_120_387.jpg)

















