4
A. SỰ CẦN THIẾT, MỤC ĐÍCH CỦA SÁNG KIẾN
Theo Ban Phát triển các chương trình môn học (Bộ GD-ĐT), chương trình môn
Hoá học cấp THPT giúp học sinh phát triển các năng lực thành phần của năng lực tìm
hiểu tự nhiên, gắn với chuyên môn về hóa học như: năng lực nhận thức kiến thức hóa
học; năng lực tìm tòi, khám phá kiến thức hóa học; năng lực vận dụng kiến thức hóa
học vào thực tiễn. Từ đó biết ứng xử với tự nhiên một cách đúng đắn, khoa học và có
khả năng lựa chọn nghề nghiệp phù hợp với năng lực và sở thích, điều kiện và hoàn
cảnh của bản thân.
Chương trình Hoá học lớp 10 trang bị cho học sinh các kiến thức cơ sở chung
về cấu tạo chất và quá trình biến đổi hoá học, là cơ sở lý thuyết chủ đạo để giải thích
được bản chất, nghiên cứu được quy luật ở các nội dung hoá học vô cơ ở lớp 11 và hoá
học hữu cơ ở lớp 12.
Điểm mới quan trọng nhất trong chương trình là định hướng tăng cường bản
chất hoá học của đối tượng; giảm bớt và hạn chế các nội dung phải ghi nhớ máy móc
cũng như phải tính toán theo kiểu “toán học hoá”, ít đi vào bản chất hoá học và thực
tiễn. Để phát triển phẩm chất và năng lực của người học, chương trình chú trọng
trang bị các khái niệm công cụ và phương pháp sử dụng công cụ. Đặc biệt là giúp học
sinh có kỹ năng thực hành thí nghiệm, kỹ năng vận dụng các tri thức hoá học vào việc
tìm hiểu và giải quyết ở mức độ nhất định một số vấn đề của thực tiễn, đáp ứng được
yêu cầu của cuộc sống.
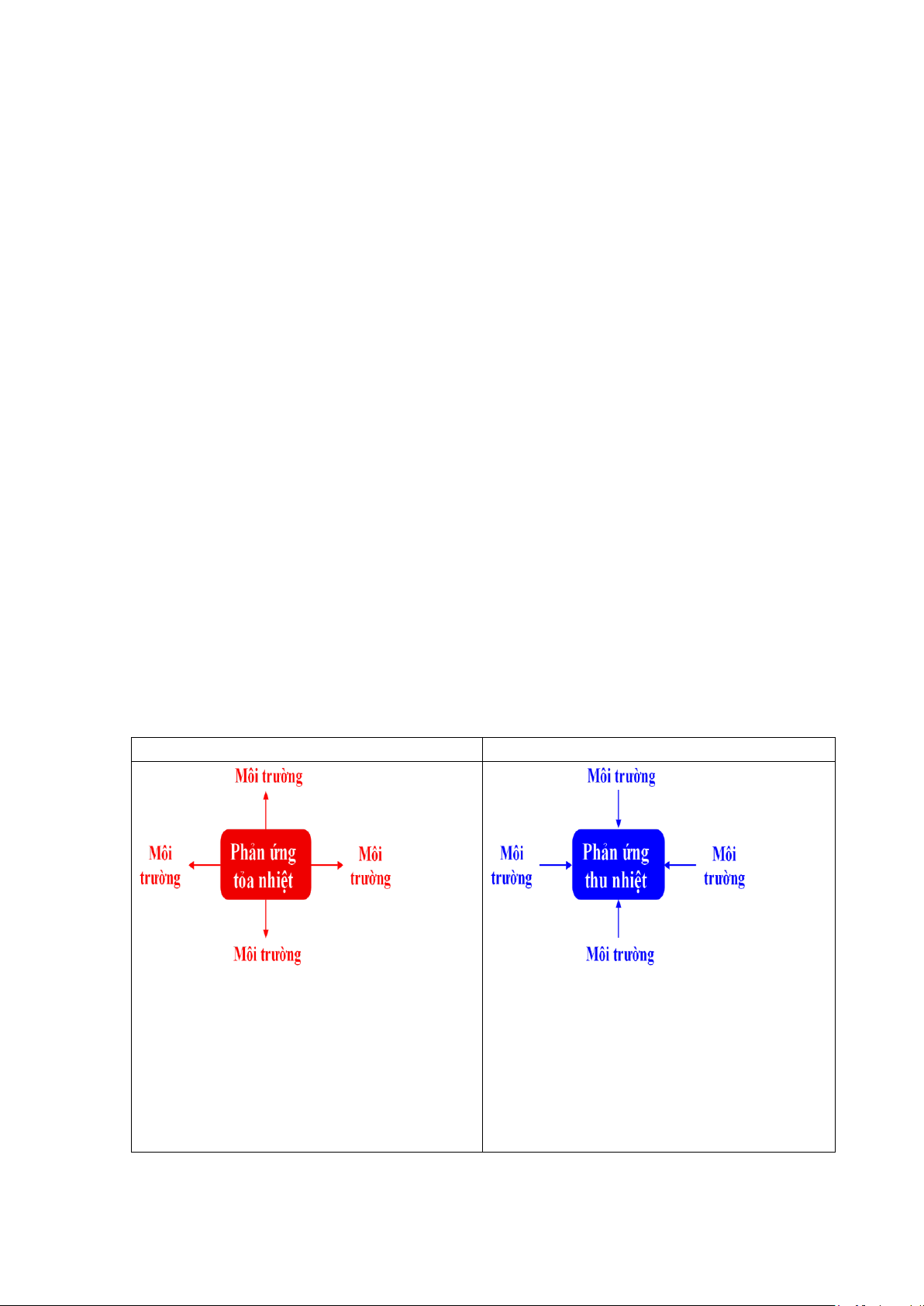
Trong nội dung kiến thức hóa học lớp 10 mới, có chương 5 NĂNG LƯỢNG
HÓA HỌC là một trong các kiến thức cơ sở mới so với chương trình GDPT cũ, chính
vì vậy tôi đã xây dựng hệ thống bài tập để sử dụng cho quá trình giảng dạy nội dung
này. Sáng kiến chủ yếu đưa ra một số dạng bài tập cơ bản và hệ thống bài tập ôn
luyện trong chương trình giúp cho quá trình giảng dạy của tôi thuận lợi hơn, giúp học
sinh phân định được các dạng bài tập, nhận thức vấn đề rõ ràng hơn, vận dụng được
kiến thức vào giải quyết một số vẫn đề thực tiễn đồng thời thấy được giữa các môn học
có mối quan hệ với nhau (phần kiến thức này có liên quan và sử dụng một số kiến thức
vật lí, sinh học), thấy được hóa học gần gũi với đời sống. Để từ đó các em yêu thích
môn học hơn.
B. PHẠM VI TRIỂN KHAI THỰC HIỆN
Xây dựng và sử dụng bài tập về năng lượng hóa học trong chương trình hóa học
lớp 10 phát huy tính tích cực, chủ động và sáng học sinh tại trường THPT Thành phố
Điện Biên Phủ.
C. NỘI DUNG
I. Tình trạng giải pháp đã biết
Trong chương trình giáo dục phổ thông hiện tại, dạng bài tập này không có
nhiều trong sách giáo khoa; chủ yếu nằm trong các giáo trình cao đẳng, đại học; tại
nhà trường việc xây dựng hệ thống bài tập cho học sinh lớp 10 còn chưa đầy đủ. Vì
vậy, Xây dựng và sử dụng bài tập về năng lượng hóa học trong chương trình hóa học
lớp 10 phát huy tính tích cực, chủ động và sáng học sinh tại trường THPT Thành phố
Điện Biên Phủ là việc cần thiết phải thực hiện.
II. Nội dung của sáng kiến mới
1. Mục đích cụ thể
a) Mục đích của sáng kiến