
CHƯƠNG 2
CÁC DẠNG LIÊN KẾT
TRONG CHẤT RẮN
PGS. TS. NGUYỄN NGỌC HÀ 1
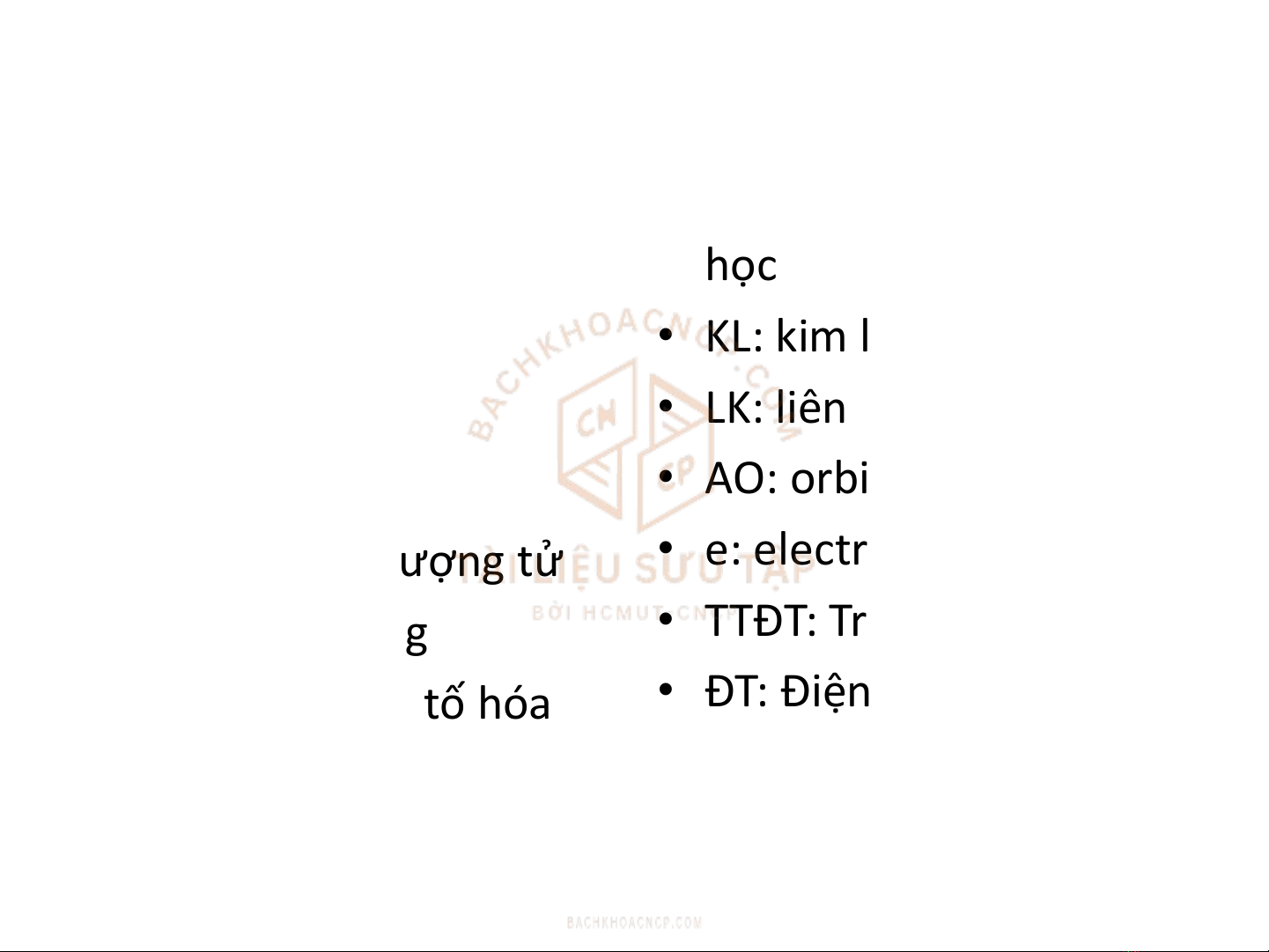
VIẾT TẮT
•NT: nguyên tử
•PT: phân tử
•HN: hạt nhân
•VC: Vật chất
•LT: lượng tử
•CHLT: cơ học lượng tử
•NL: năng lượng
•NTHH: nguyên tố hóa
học
•HCHH: hợp chất hóa
học
•KL: kim loại
•LK: liên kết
•AO: orbital nguyên tử
•e: electron
•TTĐT: Trạng thái điện tử
•ĐT: Điện từ
•T: Nhiệt độ
PGS. TS. NGUYỄN NGỌC HÀ 2

MỞ ĐẦU
NT là những phần tử cơ bản cấu tạo nên vật chất
NT liên kết tạo nên phân tử; các PT liên kết tạo khối
vật chất lớn hơn
Bản chất liên kết: được giải thích như lực hút giữa
các hạt tích điện
Quan điểm CHLT: khi HN các NT tham gia liên kết sẽ
sắp xếp lại mật độ e lớp ngoài cùng (e hóa trị)
Độ bền liên kết: năng lượng phá hủy nó
PGS. TS. NGUYỄN NGỌC HÀ 3

1. CẤU TẠO NGUYÊN TỬ
1.1. CẤU TẠO NT THEO MÔ HÌNH BOHR
NT gồm HN hình cầu và các e bao quanh
Điện tích dương của hạt nhân Z bằng số lượng các e
bao quanh: NT trung hòa điện
Các e quay quanh HN theo quỹ đạo tròn có bán
kính rn:
rn= n2.0,53.10-8m (n: số tự nhiên)
Mỗi quỹ đạo ứng với một giá trị n với một mức NL
En xác định, n: số lượng tử chính (số LT quỹ đạo)
PGS. TS. NGUYỄN NGỌC HÀ 4

1.1. CẤU TẠO NT THEO MÔ HÌNH BOHR
Mỗi e có mức NL En phụ thuộc vào Z và n; n càng lớn
mức năng lượng càng cao
Khi hấp thụ NL, e sẽ chuyển lên mức NL cao hơn (trạng
thái bị kích thích), tồn tại ở trạng thái này 10-7 – 10-9 s,
sau đó về trạng thái ban đầu, giải phóng NL bằng NL
hấp thụ:
∆E= h= E2 – E1
E1: mức năng lượng ban đầu của e
E2: mức năng lượng của quỹ đạo cuối của e
PGS. TS. NGUYỄN NGỌC HÀ 5














![Bài giảng Ứng dụng tin học trong Kỹ thuật phương tiện thủy [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251216/anhquangvu03@gmail.com/135x160/12021765937860.jpg)





![Bài tập tối ưu trong gia công cắt gọt [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251129/dinhd8055/135x160/26351764558606.jpg)





