

Th t l p : ứựớ n = 1 2 3 4 5 6 7
Tên l p : ớK L M N O P Q
Tên phân l p : ớs s,p s,p,d
Số electron tối đa trong từng phân lớp:
Tóm tắt kiến thức bài 4: Cấu Tạo Vỏ Nguyên Tử
s là 2e, p là 6e, d là 10e, f là 14e.
Số electron tối đa trong từng lớp : 1(K) 2(L) 3(M) 4(N)
2 8 16 32
Công thức tổng quát tính số e tối đa của lớp n là : 2n2

Giáo Viên: Ngô Quang Huy
Bài 5. C U HÌNH ELECTRON Ấ
NGUYÊN T (Ửt1- bài này 2 ti tế)
Bài 5: CẤU HÌNH ELECTRON NGUYÊN TỬ
Bài 5: CẤU HÌNH ELECTRON NGUYÊN TỬ
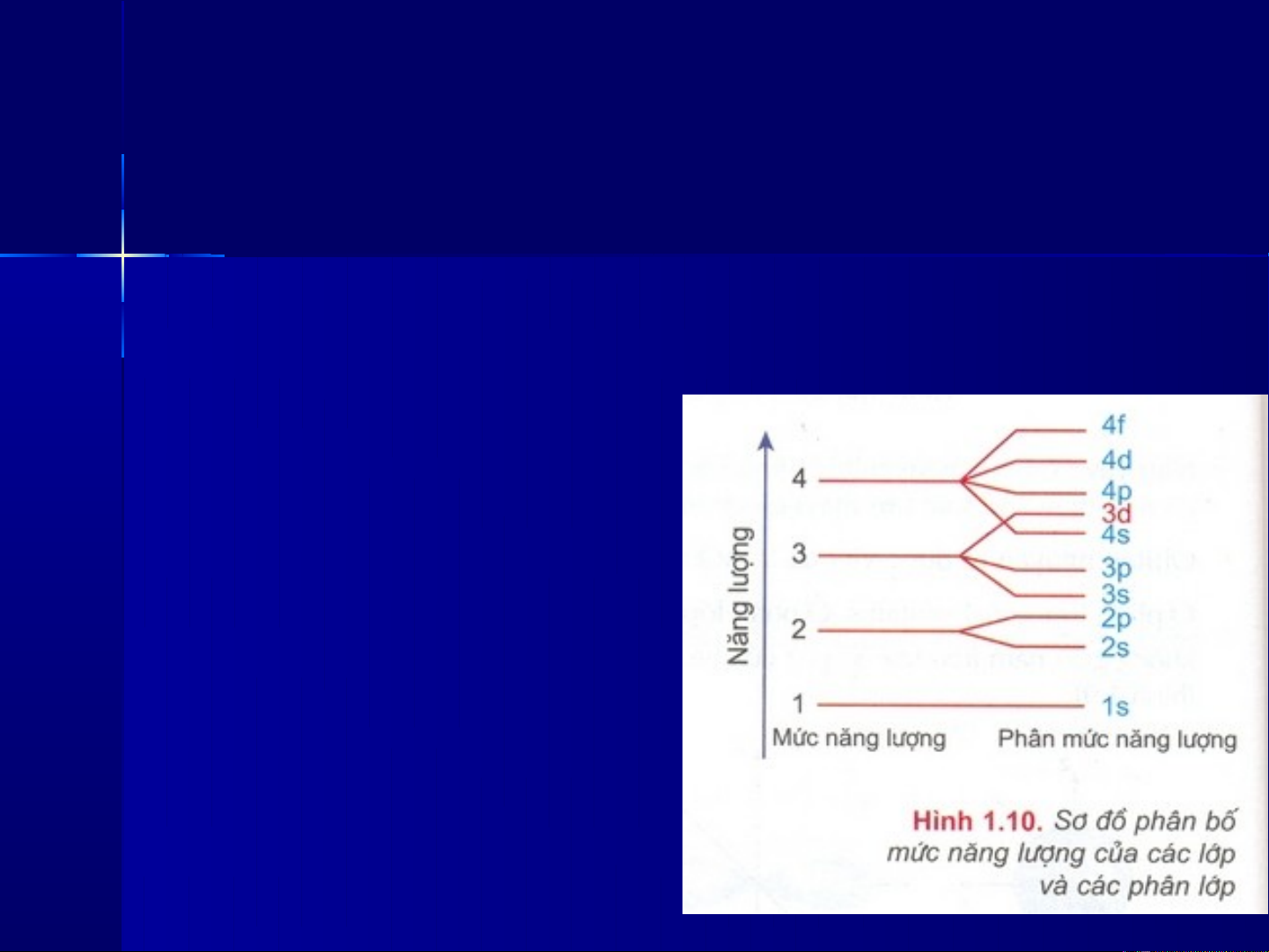
I . THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ
1s 2s 2p 3s 3p 4s 3d 4p 5s…
- Các electron trong nguyên tử lần lượt chiếm các mức năng
lượng từ thấp đến cao.
- Mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7 kể từ
hạt nhân và các phân lớp tăng theo thứ tự s, p, d, f.
- Thứ tự sắp xếp các phân
lớp theo chiều tăng của
năng lượng:
- Khi điện tích hạt nhân
tăng có sự chèn mức năng
lượng làm cho mức năng
lượng phân lớp 3d > 4s.

II. Cấu hình electron của nguyên tử.
II. Cấu hình electron của nguyên tử.
1.
1. Cấu Hình Electron Của Nguyên Tử.
Cấu Hình Electron Của Nguyên Tử.
Bài 5: C U HÌNH ELECTRON C A NGUYÊN TẤ Ủ Ử
I . Th t các m c năng l ng trong nguyên t .ứ ự ứ ượ ử
1s 2s 2p 3s 3p 4s 3d 4p 5s…
- C u hình e là cáchấ bi u di n s phân b electronể ễ ự ố
trên các phân l p thu c các l p khác nhau.ớ ộ ớ
Quy cướ Cách vi t c u hình electron nguyên t :ế ấ ử
+ S th t l p e ố ứ ự ớ đ c ghi b ng ượ ằ ch s (1, 2, ữ ố
3…).
+ Phân l pớ đ c ghi b ng ch cái th ngượ ằ ữ ườ (s, p, d,
f).
+ S e đ c ghi b ng s phía trên bên ph i c a ố ượ ằ ố ở ả ủ
phân l p (sớ2, p6 ,d10…).


























