

KIÓM TRA BµI Cò
Hãy vi t c u hình electron l p ngoài cùng c a các ế ấ ớ ủ
nguyên t nguyên t sau và xác đ nh v trí trong b ng ử ố ị ị ả
tu n hoàn:ầ
A. 11Na B. 15P
Trong m t chu kỳ, m t nhóm đ âm đi n thay đ i nh th nào?ộ ộ ộ ệ ổ ư ế
gi i thích?ả
TI T 15,16: BÀI (8+9) Ế
S BI N Đ I TU N HOÀN C U HÌNH ELECTRON,Ự Ế Ổ Ầ Ấ
TÍNH CH T C A CÁC NGUYÊN T HÓA H C,Ấ Ủ Ố Ọ
Đ NH LU T TU N HOÀN Ị Ậ Ầ
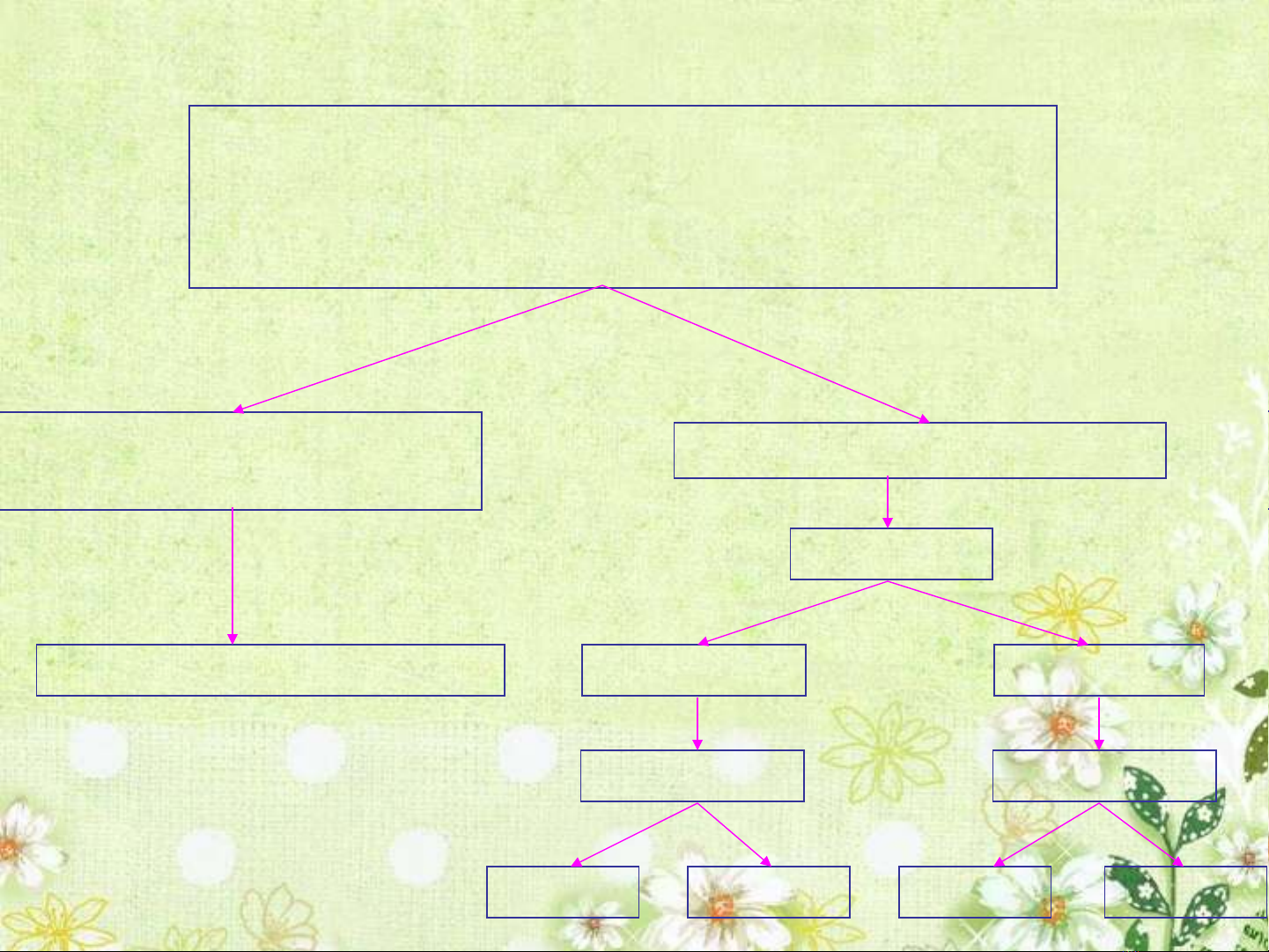
I.S bi n đ i tu n hoàn ự ế ổ ầ
c u hình eletron nguyên tấ ử
Trong chu kỳ Trong nhóm
II.Tính kim lo i, tính phi kimạ
Đ âm di nộ ệ
Tính kl ↓
L p đi l p l i sau m i chu kỳặ ặ ạ ỗ
Đ âm điên ↑ộ
Tính pk ↑
Đ âm điên ↓ộ
Tính kl ↑ Tính pk ↓
TI T 17: BÀI (8+9) Ế
S BI N Đ I TU N HOÀN C U HÌNH ELECTRON,Ự Ế Ổ Ầ Ấ
TÍNH CH T C A CÁC NGUYÊN T HÓA H C,Ấ Ủ Ố Ọ
Đ NH LU T TU N HOÀN Ị Ậ Ầ
N I DUNG BÀI H CỘ Ọ
IV. OXIT VÀ HIDROXIT C A CÁC NGUYÊN T NHÓM A THU C CÙNG CHU KỲỦ Ố Ộ
V- Đ NH LU T TU N HOÀNỊ Ậ Ầ
III. HÓA TR C A CÁC NGUYÊN TỊ Ủ Ố
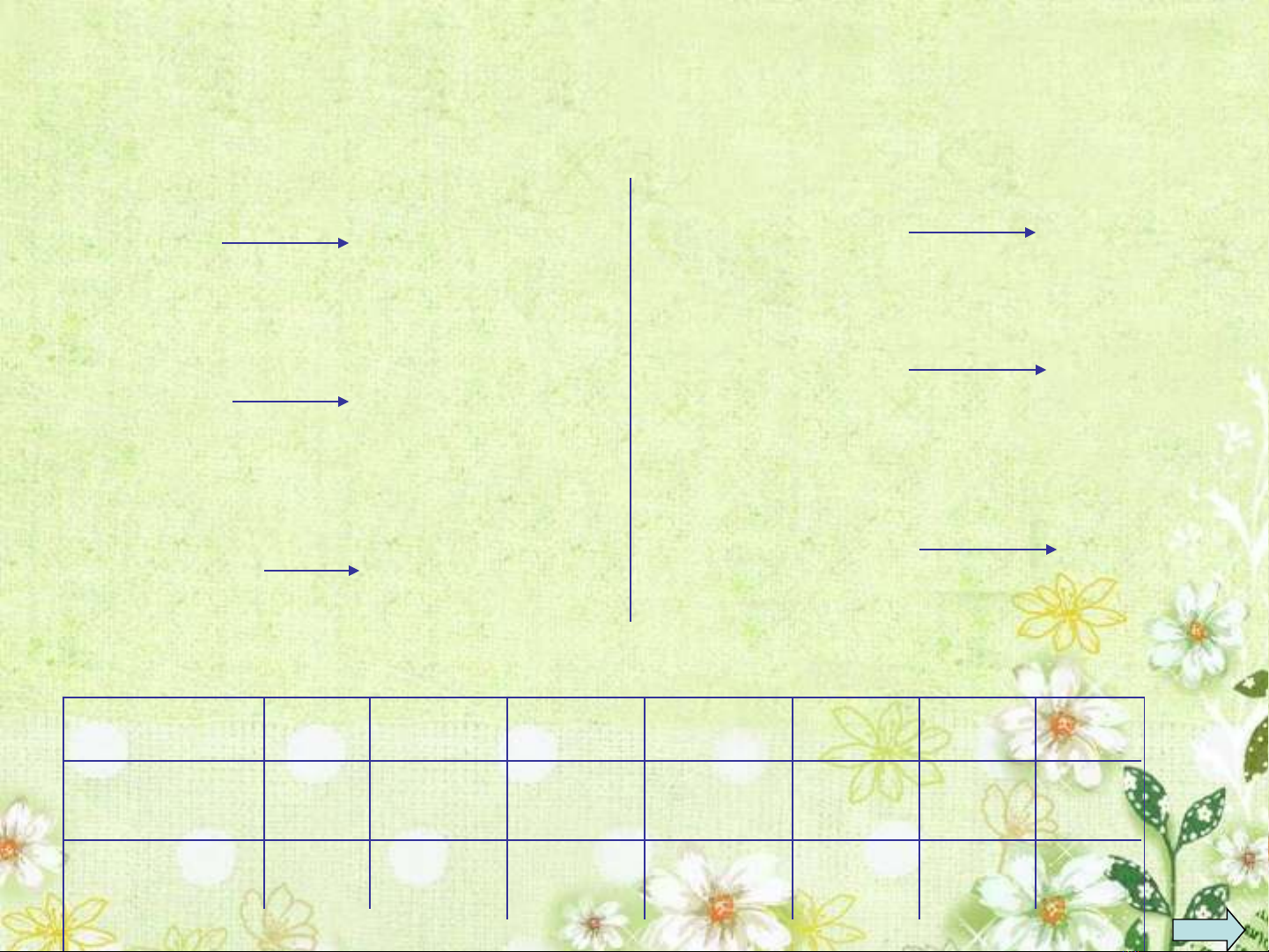
11Na: 3s1
12Mg: 3s2
13Al: 3s23p1
15P: 3s23p3
16S: 3s23p4
17Cl: 3s23p5
C u hình e l p ngoài cùng c a m t s nguyên t ấ ớ ủ ộ ố ố
và hóa tr cao nh t v i oxi:ị ấ ớ
Hóa tr : Iị
Hóa tr : IIị
Hóa tr : IIIị
Hóa tr : Vị
Hóa tr :VI ị
Hóa tr : VIIị
Chu kì 3:
Nhóm IA IIA IIIA IVA VA VIA VIIA
Nguyên t ố11Na 12Mg 13Al 14Si 15P 16S 17Cl
hóa tr I II III IV V VI ị
VII


























