HÓA HỌC PROTEIN
1

I. Đại cương protein
•Protein là một polymer sinh học
Pr = n × acid amin
•Vai trò:
▫“Tạo hình”:
▫“Dinh dưỡng”:
▫“Sinh học”: Hemoglobin, enzym, hormon,…
•Nguồn thu:
•Phân biệt:
▫Acid amin:
▫Peptid: 2 < n < 50
▫Protein: n > 50
2
II. Acid amin (aa)
Vai trò:
•Là đơn vị cơ bản tạo nên toàn bộ các protein
•Có 20 loại aa và 2 dạng amid
Về mặt hóa học:
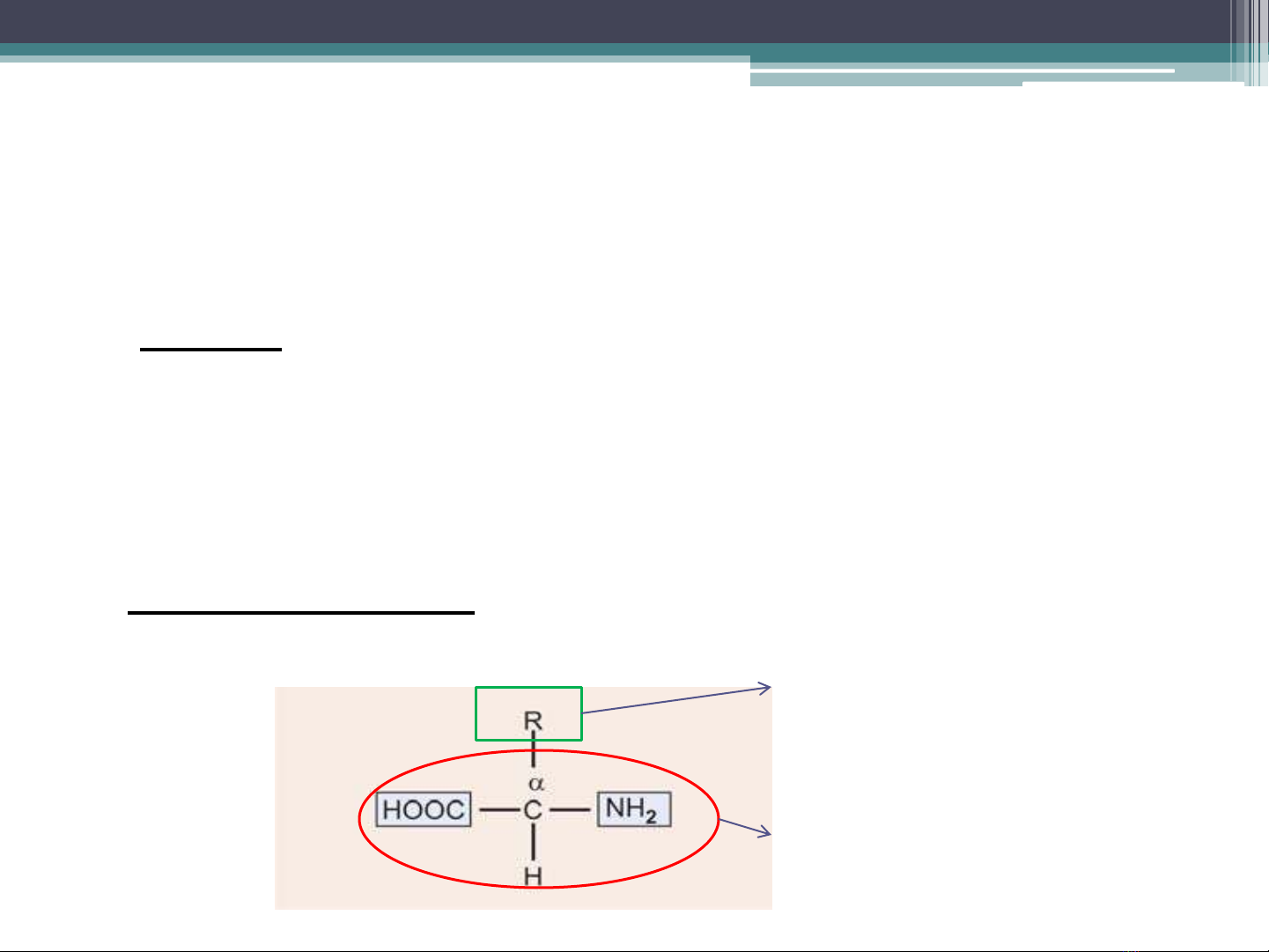
1. Định nghĩa
3
Phần chung
của aa
Gốc riêng
của mỗi aa

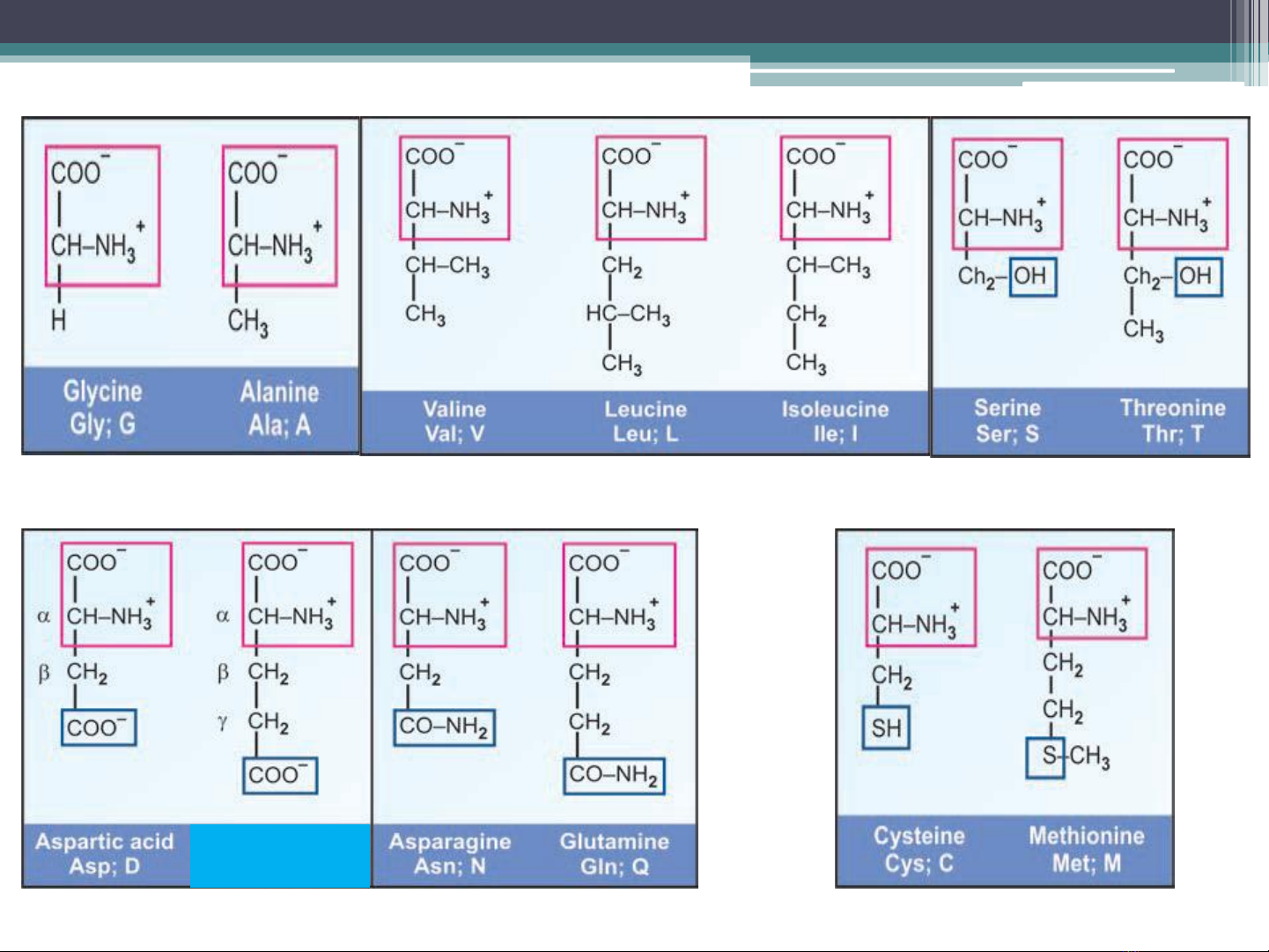
2. Phân loại
Thành phần cấu tạo: Gốc R và số –COOH, -NH2
•Acid monoamin monocarboxylic
+Gly, Ala, Leu, Ileu, Val, Ser, Thr
+Cys, Met _ aa chứa lưu huỳnh
+Ser, Thr _ aa chứa -OH
•Acid monoamin dicarboxylic: Asp, Glu
•Acid diamin monocarboxylic: Lys, Arg
•Amid của acid amin: Asn (Asparagin), Gln (Glutamin)
•Acid amin vòng: Phe, Tyr, His, Trp, Pro
4
5
Glutamic acid
Glu; E












![Bài giảng Vi sinh vật: Đại cương về miễn dịch và ứng dụng [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251124/royalnguyen223@gmail.com/135x160/49791764038504.jpg)