
Trường Đại học Khoa học Tự nhiên
Khoa Hóa – Bộ môn Hóa Học Hữu cơ
HA HU CƠ 1
1
Chương 1 : Cấu trúc nối hóa học
1. Cấu trúc của nguyên tử
2
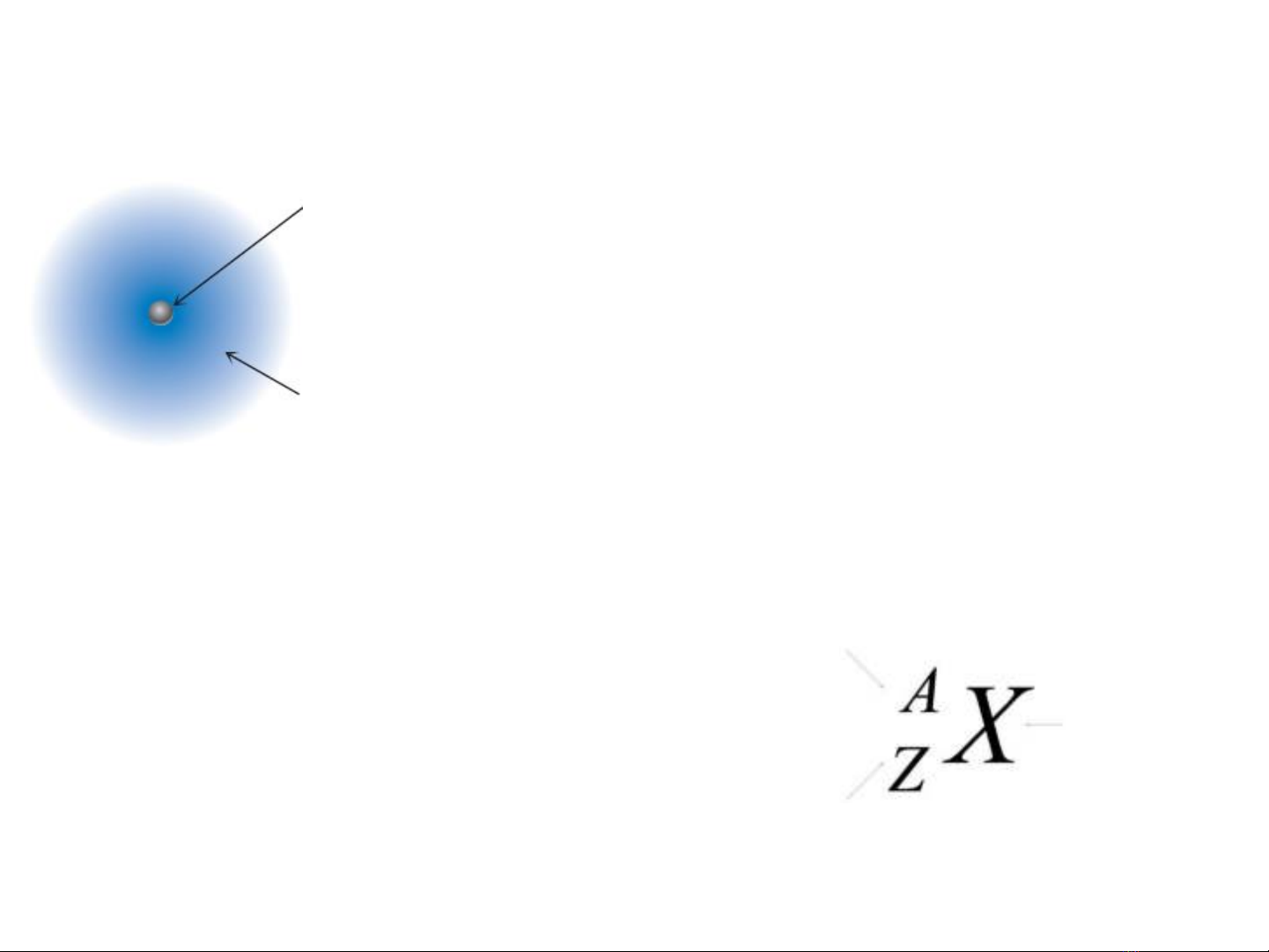
Hạt nhân
(proton + neutron)
Không gian
chứa các electron
•Đồng vị:
Các nguyên tử có cùng số hiệu nguyên tử
(Z), nhưng khác nhau về số khối (A) được gọi
là các đồng vị.
•Khối lượng nguyên tử:
Là khối lượng trung bình của các đồng vị tự
nhiên, tính bằng đơn vị khối lượng (amu).
Ký hiệu
nguyên tố
Số hiệu nguyên tử (số p)
Số khối (tổng số p + n)
• Nguyên tử gồm 2 phần:
Hạt nhân: ở trung tâm chứa các
proton mang điện tích dương và các
neutron không mang điện.
Các electron mang điện tích âm
quay xung quanh hạt nhân.
•Trong một nguyên tử, số e = số p nên
nguyên tử trung hòa về mặt điện tích.
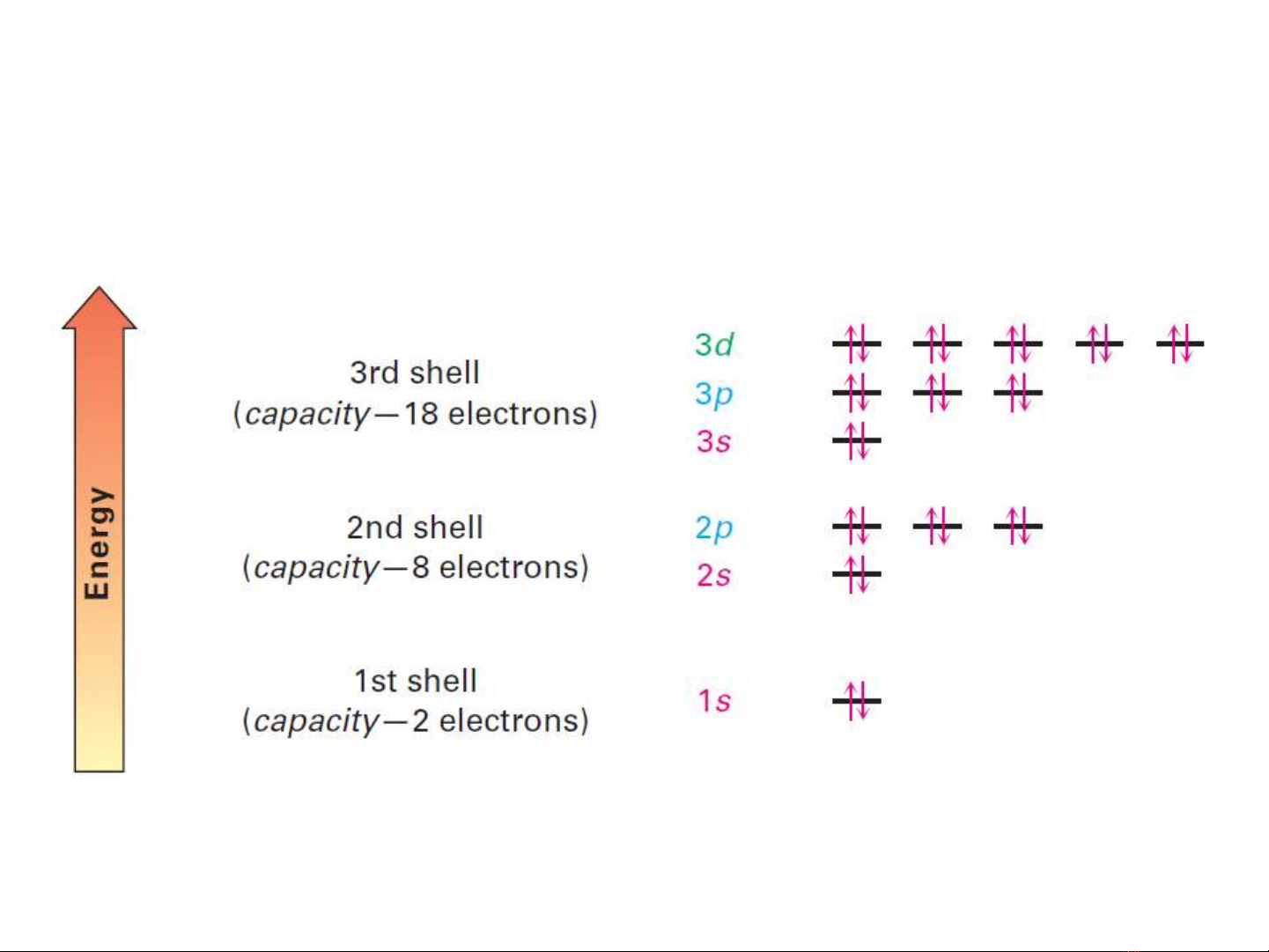
•Trong nguyên tử, các e được phân bố theo các mức năng lượng rõ rệt.
• Các lớp đầu tiên ở gần nhân nhất có mức năng lượng thấp nhất. Các lớp
xa nhân có kích thước lớn hơn và có mức năng lượng cao hơn.
3
2. Cấu trúc của nguyên tử: vân đạo (orbital)
Mức năng lượng của các điện tử trong một nguyên tử
4
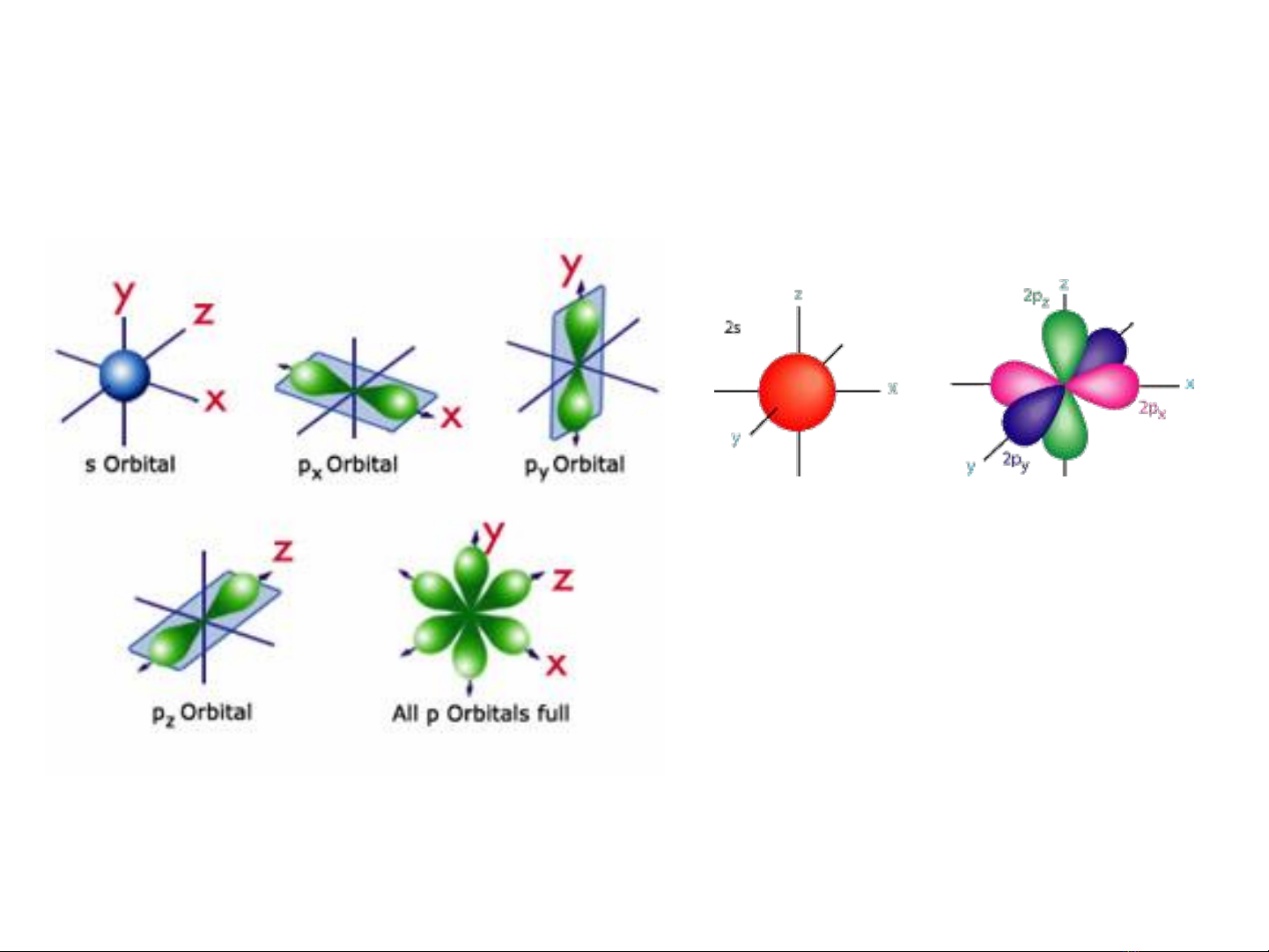
Vân đạo: vùng không gian mà ở đó điện tử xuất hiện nhiều nhất.
Vân đạo nguyên tử có các dạng cơ bản như: s, p, d, f
Vân đạo p gồm có px, py, pz
hướng lần lượt theo các trục
x, y, z.
Ba vân đạo p này thẳng góc
với nhau.
2. Cấu trúc của nguyên tử: vân đạo (orbital)
5
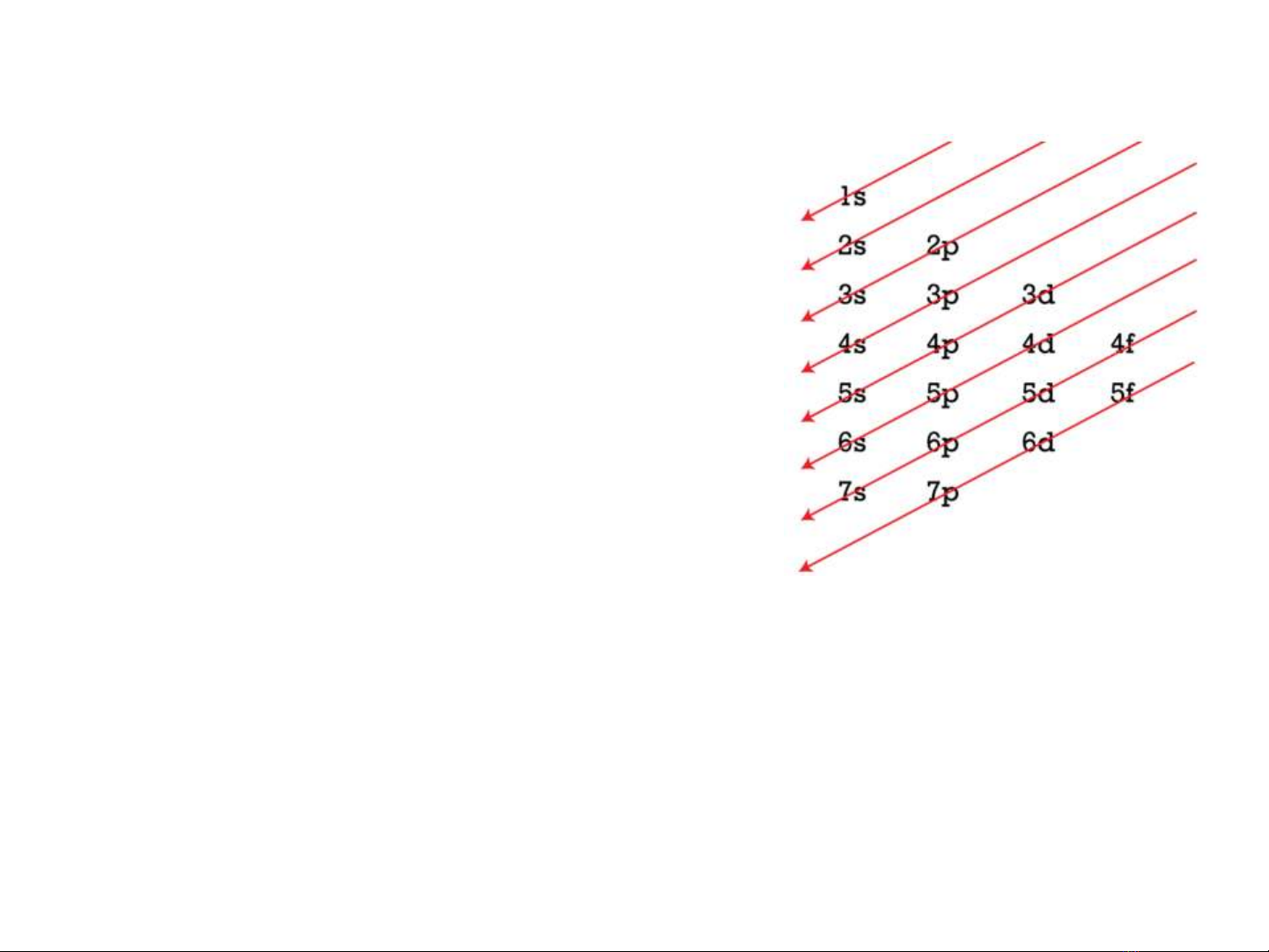
1. Nguyên lý Aufbau: Trong nguyên tử, các
electron sẽ phân bố vào các orbital theo thứ tự
năng lượng từ thấp đến cao.
3. Cấu trúc nguyên tử: cấu hình điện tử (electron configuration)
2. Nguyên lý loại trừ Pauli: Mỗi vân đạo chứa tối đa 2 electron có spin ngược
chiều nhau.
3. Quy tắc Hund: Trong cùng một phân lớp, ứng với cùng một trạng thái năng
lượng nhất định,các electron sẽ được phân bố để tổng số spin là cực đại. Nghĩa
là: Số electron độc thân (không ghép cặp) là tối đa.
Cấu hình điện tử của mỗi nguyên tử khi ở trạng thái căn bản luôn tuân theo ba
quy tắc sau:











![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














