
Ch
Chươ
ương IV
ng IV
LÝ THUY T CÂN B NG PHA Ế Ằ
LÝ THUY T CÂN B NG PHA Ế Ằ
CÂN B NG PHA TRONG H 1 C U TẰ Ệ Ấ Ử
CÂN B NG PHA TRONG H 1 C U TẰ Ệ Ấ Ử
IV.1
IV.1 Các khái ni m chungệ
Các khái ni m chungệ
IV.2
IV.2 Cân b ng pha trong h 1 c u t ằ ệ ấ ử
Cân b ng pha trong h 1 c u t ằ ệ ấ ử
IV.3
IV.3 Các gi n đ h 1 c u t : nả ồ ệ ấ ử
Các gi n đ h 1 c u t : nả ồ ệ ấ ử ư
ưc, lớc, lớư
ưu hu nh ỳ
u hu nh ỳ

CÂN B NG PHA Ằ
CÂN B NG PHA Ằ
Ví d th c t ụ ự ế
Ví d th c t ụ ự ế S chuy nự ể
S chuy nự ể
pha
pha
Tên quá
Tên quá
trình
trình
S y khô ấ
S y khô ấL ng ỏ
L ng ỏ
H iơ
H iơBay h iơ
Bay h iơ
Đng sọ
Đng sọươ
ương
ng H i ơ
H i ơ
L ngỏ
L ngỏNg ng tư ụ
Ng ng tư ụ
Băng tan
Băng tan R n ắ
R n ắ
L ngỏ
L ngỏNóng ch yả
Nóng ch yả
K t tinh ế
K t tinh ế
đ
đư
ưng t ờ ừ
ng t ờ ừ
n
nư
ưc mía ớc mía ớ
L ng ỏ
L ng ỏ
R nắ
R nắĐông đcặ
Đông đcặ
(K t tinh)ế
(K t tinh)ế
Thăng hoa Iod
Thăng hoa Iod R n ắ
R n ắ
H iơ
H iơThăng hoa
Thăng hoa
05/18/22
05/18/22 2
2
607010 - Ch ng 4ươ
607010 - Ch ng 4ươ

IV.1. CÁC KHÁI NI M CHUNG Ệ
IV.1. CÁC KHÁI NI M CHUNG Ệ
05/18/22
05/18/22 3
3
607010 - Ch ng 4ươ
607010 - Ch ng 4ươ
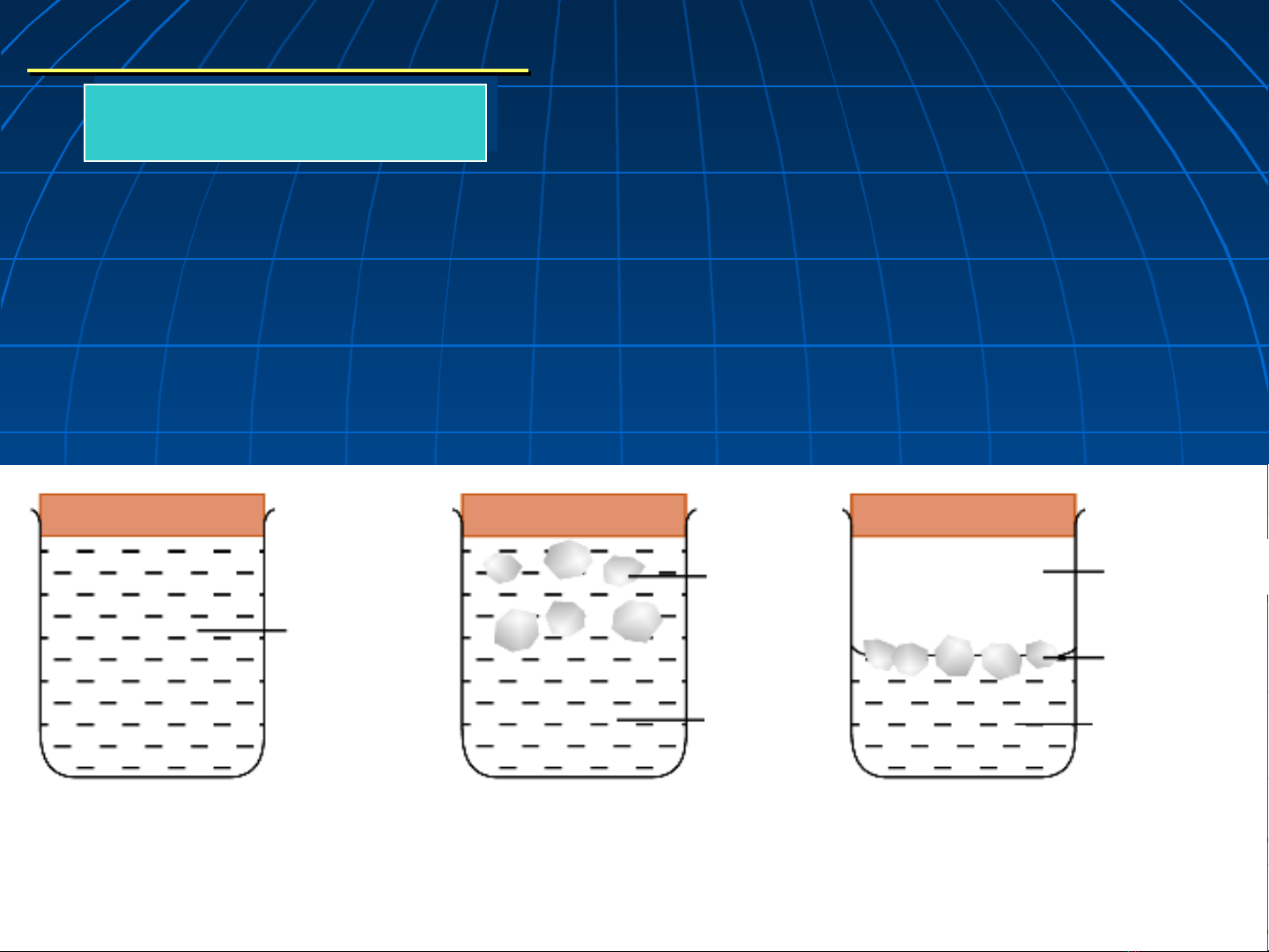
Pha - s phaố f
Pha - s phaố f
V.1.1. Các khái ni m:ệ
V.1.1. Các khái ni m:ệ
pha, h p ph n, c u t , b c t doợ ầ ấ ử ậ ự
pha, h p ph n, c u t , b c t doợ ầ ấ ử ậ ự
Pha là toàn b ph n đng th c a h n m ộ ầ ồ ể ủ ệ ằ ở
Pha là toàn b ph n đng th c a h n m ộ ầ ồ ể ủ ệ ằ ở
tr ng thái CB có các thông s nhi t đng nhạ ố ệ ộ
tr ng thái CB có các thông s nhi t đng nhạ ố ệ ộ ư
ư
nhau.
nhau.
Các pha trong h đệ
Các pha trong h đệư
ưc phân chia b i các ợ ở
c phân chia b i các ợ ở b m t ề ặ
b m t ề ặ
phân chia pha
phân chia pha.
.
H m t phaệ ộ
f = 1
H hai pha ệ
f = 2
H ba phaệ
f = 3
Nướ
c N cướ Nướ
c
N c đá ướ
H iơ
Nướ
c
đá
05/18/22
05/18/22 4
4
607010 - Ch ng 4ươ
607010 - Ch ng 4ươ
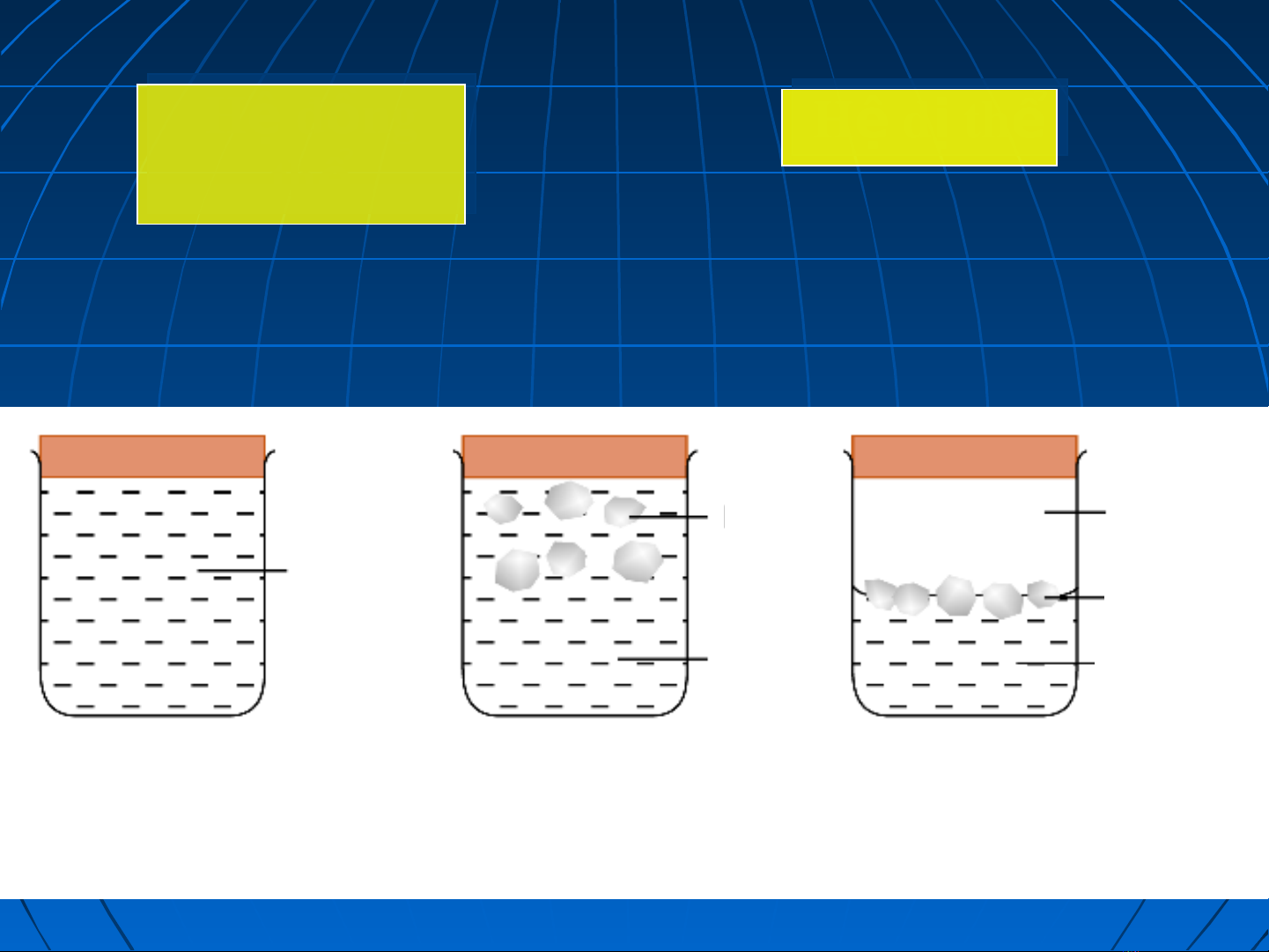
H đng ệ ồ
thể
H đng ệ ồ
thểH d thệ ị ể
H d thệ ị ể
H đng ệ ồ
th ể
f = 1
H d th ệ ị ể
f >1
Nướ
c Nướ
c
Nướ
c
N c ướ
đá
H iơ
Nướ
c
đá
- Ch g m 1 phaỉ ồ
- Không có b m t ề ặ
phân chia pha
-Có nhi u hề ơn 1 pha
- Có b m t phân chiaề ặ
pha
05/18/22
05/18/22 5
5
607010 - Ch ng 4ươ
607010 - Ch ng 4ươ

![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



![Bài giảng Nhiệt động lực học hóa học [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20241106/vipanly/135x160/371730886770.jpg)




![Thí nghiệm Vật lí (BKEM-012): Tài liệu [Mô tả/Hướng dẫn/Bài tập,...]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251219/thanhlong020907@gmail.com/135x160/54561766129946.jpg)














