1Chương 2. Môi chất và cách xác định
trạng thái của chúng
2.1. KHÍ LÝ TƯỞNG VÀ KHÍ THỰC
2.1.1. Sự khác nhau của khí thực so với khí lý tưởng

2
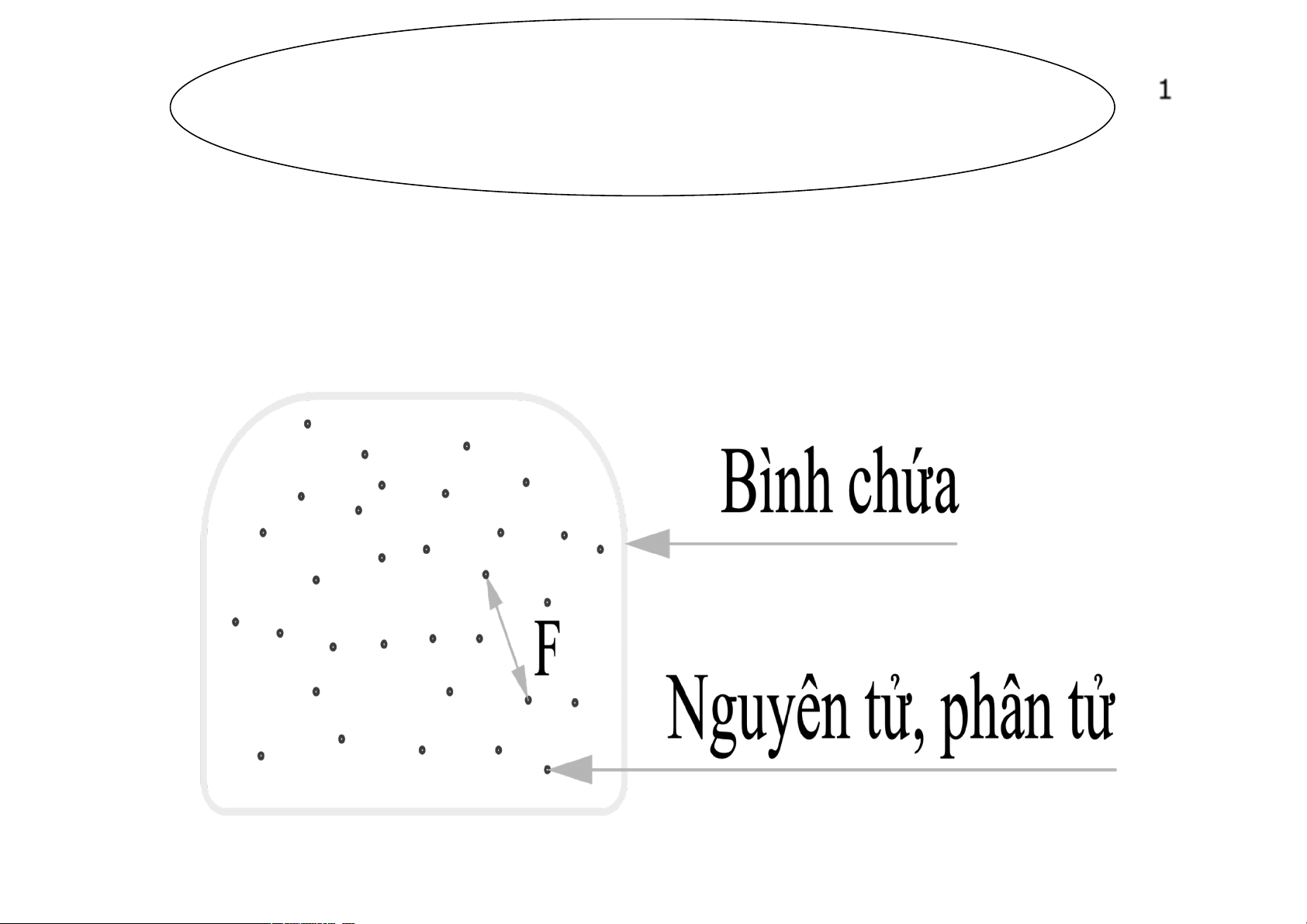
Khí lý tưởng
-Lực tác dụng giữa các phân tử:
F=0
-Độ nén:𝑧 = !"
#$, z = 1
-Nhiệt dung riêng:hằng số và chỉ
phụ thuộc tính chất của khí đó.
-Nội năng: u = f(T)
-Entanpi: i = f(T)
-Sự chuyển pha:không có
Khí thực
-Lực tác dụng giữa các phân tử:
F≠0
-Độ nén:𝑧 = !"
#$, z ≠ 1 và phụ
thuộc áp suất, nhiệt độ và tính
chất vật lý của khí đó.
-Nhiệt dung riêng:phụ thuộc tính
chất của khí đó,nhiệt độ và áp
suất.
-Nội năng: u = f(T, v/p)
-Entanpi: i = f(T, v/p)
-Sự chuyển pha:Rắn,lỏng,khí
2.1.1. Sự khác nhau của khí thực so với khí lý tưởng

3
2.1.2. Phương trình trạng thái của khí lý tưởng và khí thực
1. Phương trình trạng thái của khí lý tưởng
-Phương trình trạng thái được tìm từ thực nghiệm của:Boyle –
Mariotte và Gay –Lussac.Ngày nay được tìm ra nhờ thuyết động
học phân tử.
-Dạng tổng quát:F(p, v, T) = 0, có nghĩa cứ biết 2trong số 3thông
số trạng thái chúng ta sẽ xác định được hoàn toàn trạng thái của hệ.
-Viết cho 1kg khí lý tưởng: p𝓋=RT
p –Áp suất tuyệt đối, N/m2
𝓋–Thể tích riêng, m3/kg
R –Hằng số chất khí, J/kg.K
T –Nhiệt độ Kelvin, 0K

41. Phương trình trạng thái của khí lý tưởng (Tiếp theo)
-Viết cho G kg khí lý tưởng: p𝓋G = GRT ↔pV= GRT
-Viết cho 1 kmol khí lý tưởng: p𝓋𝜇 = 𝜇RT ↔pV𝜇= R𝜇T
- Ở điều kiện tiêu chuẩn (p = 760 mmHg, t = 00C), thể tích của 1
kmol chất khí là V𝜇= 22,4 m3.
R𝜇= p!!
"=
!"#
!$#.$%".&&,(
&)*,$+ = 8314 J/kmol.K
Mặt khác: p𝓋= RT
↔p𝓋𝜇 = 𝜇RT
↔pV𝜇= 𝜇RT
F
R = ,!
-= .*$(
-

5
2. Phương trình trạng thái của khí thực
ØĐối với khí thực không tồn tại phương trình trạng thái đúng cho tất
cả các khí thực với mọi điều kiện áp suất,nhiệt độ và thể tích riêng.
Các phương trình hiện nay chứa nhiều hằng số thực nghiệm,phụ
thuộc vào từng chất khí.
F
Phương trình trạng thái của khí thực có sai số lớn nên không sử
dụng.







![Bài giảng Kỹ thuật nhiệt: Các quá trình của không khí ẩm - Trần Thị Thu Hằng [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250506/antrongkim0609/135x160/2371746505990.jpg)
![Bài giảng Kỹ thuật nhiệt: Các quá trình nhiệt động cơ bản của khí lý tưởng - Trần Thị Thu Hằng [Chuẩn Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250506/antrongkim0609/135x160/221746505996.jpg)










![Ngân hàng trắc nghiệm Kỹ thuật lạnh ứng dụng: Đề cương [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251007/kimphuong1001/135x160/25391759827353.jpg)






