
CH NG 4ƯƠ
NÂNG CAO HI U QU S D NG PHÂN BÓNỆ Ả Ử Ụ
BÀI 1: C I THI N pH ĐT CHUA VÀ S D NG ĐT CHUAẢ Ệ Ấ Ử Ụ Ấ
pH đt và các tính ch t đi cùng v i pH đt có nh h ng r t l n đn kh năng h uấ ấ ớ ấ ả ưở ấ ớ ế ả ữ
d ng c a các ch t dinh du ng đi v i cây tr ng và đ phì nhiêu c a đt. Vì v y nghiênụ ủ ấ ỡ ố ớ ồ ộ ủ ấ ậ
c u v đ chua và đ ki m c a đt có m t t m quan tr ng đ qu n lý m t cách thích h pứ ề ộ ộ ề ủ ấ ộ ầ ọ ể ả ộ ợ
kh năng s n xu t c a đt và cây tr ng m t cách t i h o.ả ả ấ ủ ấ ồ ộ ố ả
1 Các khái ni m t ng quát v đ chua và đ ki mệ ổ ề ộ ộ ề
1.1 Acid-Base
Trong các h th ng dung d ch, acid đc đnh nghĩa là m t ch t cho Hệ ố ị ượ ị ộ ấ + đn m t ch tế ộ ấ
khác. Ng c l i m t base là ch t nh n Hượ ạ ộ ấ ậ +. M t acid khi hoà tan trong n c s ion hoáộ ướ ẽ
phân ly H+ và các anion đi kèm, ví d s phân ly c a acetic acid và hydrochloric acid nhụ ự ủ ư
sau:
CH2COOH CH2COO- + H+
HCl Cl- + H+
Kh năng phân ly Hả+ c aủ m t acid m nh nh HCl là 100 %, trong khi đó kh năngộ ạ ư ả
phân ly H+ c a m t acid y u nh acetic acid ch kho ng 1 %.ủ ộ ế ư ỉ ả
Các ion H+ (hay đ chua ho t đng) tăng theo l c acid. Khi m t acid không phân ly cóộ ạ ộ ự ộ
nghĩa là acid đó có m t đ chua ti m tàng cao. T ng đ chua c a m t dung d ch là t ngộ ộ ề ổ ộ ủ ộ ị ổ
n ng đ acid ti m tàng và ho t đng. Ví d , đ chua ho t đng và đ chua ti m tàng c aồ ộ ề ạ ộ ụ ộ ạ ộ ộ ề ủ
m t acid là 0,099 M và 0,001 M. T ng n ng đ acid là 0,100 M, vì ho t đ c a Hộ ổ ồ ộ ạ ộ ủ + (đ chuaộ
ho t đng) g n b ng v i t ng đ chua, nên acid này là m t acid m nh.ạ ộ ầ ằ ớ ổ ộ ộ ạ
Ng c l i, ượ ạ v i các acid y u, ho t đ c a Hớ ế ạ ộ ủ + th p h n r t nhi u so v i đ chuaấ ơ ấ ề ớ ộ
ti m tàng. Ví d , 0,100 M acid y u v i ch 1 % phân ly có nghĩa là ho t đ c a Hề ụ ế ớ ỉ ạ ộ ủ + là:
0,1 x 0,01 = 0,001M.
N c nguyên ch t luôn t phân ly nh :ướ ấ ự ẹ
H2O H+ + OH-
Ion H+ này s t n công vào phân t n c khác đ hình thànhẽ ấ ử ướ ể
H2O + H+ H3O+
Do c hai ion Hả+ và OH- đu đc hình thành trong dung d ch, nên n c v a có tínhề ượ ị ướ ừ
ch t c a 1 acid y u và đng th i có tính ch t c a 1 base y u. N ng đ c a Hấ ủ ế ồ ờ ấ ủ ế ồ ộ ủ + (hay H3O+)
và OH- c a n c nguyên ch t trong đi u ki n không cân b ng v i COủ ướ ấ ề ệ ằ ớ 2 trong khí quy n làể
10-7M. S n ph m c a n ng đ Hả ẩ ủ ồ ộ + và OH-, đc trình bày trong ph ng trình sau, là h ngượ ươ ằ
s phân ly (Kw) đi v i n c là:ố ố ớ ướ
[H+][OH-] = [10-7][10-7] = 10-14 = Kw
p H c a Hủ2O trong tr ng thái cân b ng v i COạ ằ ớ 2 trong khí quy n dao đng trongể ộ
kho ng 5,7, nh ph n ng sau đây:ả ư ả ứ
H2CO3
H2O + CO2 H + + HCO3
-
Khi cho thêm m t acid vào Hộ2O s làm tăng [Hẽ+] nh ng [OHư-] s gi m vì Kw là m tẽ ả ộ
h ng s (10ằ ố -14). Ví d , trong m t dung d ch 0,1M HCl, có [Hụ ộ ị +] là 10-1M vì th [OHế-] là:
Kw = [H+][OH-] = 10-14
[10-1][OH-] = 10-14
[OH-]= 10-13M
1
1.2 Khái ni m pHệ
[H+] th ng đc di n t b ng cách dùng thu t ng pH vì cách di n t này s thu nườ ượ ễ ả ằ ậ ữ ễ ả ẽ ậ
l i h n, và pH đc đnh nghĩa nh sau:ợ ơ ượ ị ư
pH = log 1 / [H+] = -log[H+]
T đnh nghĩa này ta th y m iừ ị ấ ỗ khi tăng 1 đn v pH s t ng ng v i vi c gi m10ơ ị ẽ ươ ứ ớ ệ ả
l n [Hầ+]. Ví d , m t dung d ch có [Hụ ộ ị +] = 10-5 s có pH là 5,0.ẽ
Các dung d ch có pH < 7 là các dung d ch có tính chua, và các dung d ch có pH>7ị ị ị
là các dung d ch có tính ki m, các dung d ch có pH = 7 là các dung d ch trung tính.ị ề ị ị
pH là thu t ng ch th hi n n ng đ Hậ ữ ỉ ể ệ ồ ộ + trong dung d ch và không đo đc đ chua khôngị ượ ộ
phân ly hay đ chua ti m tàng c a dung d ch. Ví d , pH c a 0,1 M HCl phân ly hoàn toàn làộ ề ủ ị ụ ủ
1,0, ng c l i pH c a 0,1M CHượ ạ ủ 2COOH, m t acid y u là 3,0. T ng t , pH c a 0,1 Mộ ế ươ ự ủ
NaOH, m t base m nh, là 13,0, trong khi đó pH c a 0,1 M NHộ ạ ủ 4OH, m t base y u là 11,0.ộ ế
B ng 4.1 ảQuan h gi a pH và n ng đ [Hệ ữ ồ ộ +] và [OH-]
pH N ng đồ ộ
H+OH-
1 10-1 10-13
2 10-10-12
3 10-3 10-11
4 10-4 10-10
5 10-5 10-9
6 10-6 10-8
7 10-7 10-7
8 10-18 10-6
9 10-9 10-5
10 10-10 10-4
11 10-11 10-3
12 10-12 10-2
13 10-13 10-1
14 10-14 10-0
Khi các acids và bases k t h p v i nhau, c hai ion Hế ợ ớ ả + và OH- đu b trung hoà, hìnhề ị
thành m t mu i và n c:ộ ố ướ
HCl + NaOH H2O + Na+ + Cl-
H+ Cl- Na+ OH-
N u 1 l ng acid đc chu n đ v i 1 base và pH c a dung d ch đc xác đnh theoế ượ ượ ẩ ộ ớ ủ ị ượ ị
t ng quá trình chu n đ, chúng ta s thu đng cong trên m t đ th v i tr c y là giá tr pHừ ẩ ộ ẽ ườ ộ ồ ị ớ ụ ị
và tr c x là các giá tr l ng base đc thêm vào. ụ ị ượ ượ Đng cong chu n đ c a các acid y uườ ẩ ộ ủ ế
và m nh khác nhau r t rõ ràng. Ví d , ph n ng trung hoà c a HCl và NaOH đc trìnhạ ấ ụ ả ứ ủ ượ
bày trong ph ng trình trên, và ph n ng c a CHươ ả ứ ủ 3COOH v i NaOH nh sau:ớ ư
CH3COOH + NaOH H2O + CH3COO- + Na+
CH3COO- + H+ Na+ OH-
2

2 Tính đm pHệ
M t h th ng có tính đm có th duy trì đc pH c a dung d ch trong m t kho ngộ ệ ố ệ ể ượ ủ ị ộ ả
bi n thiên nh t đnh khi 1 l ng nh acid hay base đc thêm vào. Kh năng đm pHế ấ ị ượ ỏ ượ ả ệ
đc đnh nghĩa là kh năng ch ng l i s thay đi đt ng t v pH c a h th ng. M t víượ ị ả ố ạ ự ổ ộ ộ ề ủ ệ ố ộ
d v m t h th ng đm là h n h p CHụ ề ộ ệ ố ệ ỗ ợ 3COOH và CH3COONa.
CH3COOH H+ + CH3COO-
CH3COONa Na+ + CH3COO-
Ví d , m t dung d ch ch a 1 M CHụ ộ ị ứ 3COOH có pH là 2, nh ng khi dung d ch y cóư ị ấ
n ng đ 1M CHồ ộ 3COOH và 1M CH3COONa s có pH là 4.6. Khi cho thêm m t mu i cóẽ ộ ố
tính phân ly m nh CHạ3COONa vào dung d ch ch a CHị ứ 3COOH, s làm tăng n ng đ c aẽ ồ ộ ủ
CH3COO-, s gia tăng n ng đ CHự ồ ộ 3COO- này s thay đi s cân b ng đ hình thànhẽ ổ ự ằ ể
CH3COOH acid không phân ly. Nh ng chú ý là pH v n gi 4,6 ngay c khi pha loãngư ẫ ữ ở ả
dung d ch này g p 10 l n v i n c; tuy nhiên, khi ch pha loãng dung d ch 1M CHị ấ ầ ớ ướ ỉ ị 3COOH
có th s làm tăng pH lên 3,0. Vì v y, khi cho CHể ẽ ậ 3COONa vào CH3COOH, h n h p này sổ ợ ẽ
đm đc pH c a dung d ch. H n h p dung d ch này ta g i là dung d ch đm.ệ ượ ủ ị ỗ ợ ị ọ ị ệ
N u thêm 10 ml 1M HCl vào dung d ch đm CHế ị ệ 3COOH/CH3COONa, pH s chẽ ỉ
gi m đn 4,5, b i vì khi Hả ế ở + đc thêm vào s làm thay đi cân b ng CHượ ẽ ổ ằ 3COOH H+ +
CH3COO- v bên trái và do n ng đ CHề ồ ộ 3COO- gi m nên CHả3COO- s phân ly tẽ ừ
CH3COONa và gi i phóng vào dung d ch (s cân b ng thay đi v phía ph i CHả ị ự ằ ổ ề ả 3COONa
CH3COO- + Na+).
Ng c l i, n u thêm 10ml 1M NaOH vào dung d ch CHượ ạ ế ị 3COOH/CH3COONa, OH-
s trung hoà Hẽ+ trong h n h p đ hình thành n c. Do có s cung c p 1 l ng CHỗ ợ ể ướ ự ấ ượ 3COOH
acid không phân ly l n, nên s cân b ng s thay đi v phía ph i, đ bù đp l ng Hớ ự ằ ẽ ổ ề ả ể ắ ượ + bị
trung hoà; vì v y pH ch tăng lên đn 4,7.ậ ỉ ế
Đt có tính ch t nh là 1 acid y u do CEC c a ch t mùn và các khoáng sét làm choấ ấ ư ế ủ ấ
dung d ch đt có tính đm pH.ị ấ ệ
3 Đt chuaấ
Kho ng 25 % - 30 % di n tích đt trên th gi i b chua, phân b t i các khu v cả ệ ấ ế ớ ị ố ạ ự
s n xu t l ng th c quan tr ng.ả ấ ươ ự ọ
3.1 Ngu n g c phát sinh đ chua c a đtồ ố ộ ủ ấ
Ngu n g c phát sinh đ chua c a đt bao g m ch t h u c , các khoáng sét, cácồ ố ộ ủ ấ ồ ấ ữ ơ
oxides Fe và Al, Al3+ trao đi, các mu i hoà tan, COổ ố 2 và khoáng pyrite b oxi hóa.ị
3.1.1 Mùn
Ch t h u c hay mùn trong đt ch a các nhóm carboxyl và phenol t o nên các ph nấ ữ ơ ấ ứ ạ ả
ng hoá h c và có tính ch t nh các acids y u. Chúng s phân ly, gi i phóng Hứ ọ ấ ư ế ẽ ả +. Hàm
l ng ch t h u c trong đt thay đi theo đi u ki n môi tr ng, th m th c v t, và lo iượ ấ ữ ơ ấ ổ ề ệ ườ ả ự ậ ạ
đt; vì v y m c đ gây chua c a mùn đi v i đt s thay đi tùy theo hàm l ng ch tấ ậ ứ ộ ủ ố ớ ấ ẽ ổ ượ ấ
h u c . Trong đt than bùn và đt khoáng có ch a nhi u ch t h u c , các acid h u c gópữ ơ ấ ấ ứ ề ấ ữ ơ ữ ơ
ph n l n vào vi c t o nên đ chua c a đt.ầ ớ ệ ạ ộ ủ ấ
Ch t h u c -C ấ ữ ơ R-COOH R-COO- + H+
3.1.2 Các khoáng sét
Các khoáng sét trong đt tiêu bi u là kaolinite (1:1) và montmorillonite (2:1) có thấ ể ể
đm pH c a đt. S phân ly Hệ ủ ấ ự + t các “c nh b v ” c a các khoáng sét, các b m t c a cácừ ạ ị ỡ ủ ề ặ ủ
oxides Fe, Al, và ch t h u c góp ph n t o nên kh năng đm pH trong đt. Đt có ch aấ ữ ơ ầ ạ ả ệ ấ ấ ứ
3

sét và/hay ch t h u c cao s th hi n kh năng đm (BC) l n h n là đt có sa c u thôấ ữ ơ ẽ ể ệ ả ệ ớ ơ ấ ấ
và/hay ch a ch t h u c th p. Đi n tích ph thu c pH và BC c a các khoáng sét, cácứ ấ ữ ơ ấ ệ ụ ộ ủ
oxides Fe, Al, và ch t h u c đc di n t nh sau:ấ ữ ơ ượ ễ ả ư
Trên các oxides Fe và Al
OHH+ OH O-
H+ OH-
[Fe, Al] [Fe, Al] [Fe, Al]
OHH+OH O-
Chua Trung tính Ki mề
Trên các khoáng sét:
O O O
Si Si Si
O HH+ H+ O H OH- O
Al Al Al
O HH+O H O
Chua Trung tính Ki mề
Trên ch t h u c :ấ ữ ơ
OH-
RCOOH RCOO-
Chua Ki mề
OH-
ROH RO-
Chua Ki mề
3.1.3 Các polymers Fe và Al
Các ions Al3+ đc thay th t b m t h p ph c a các khoáng sét (CEC) s b th yượ ế ừ ề ặ ấ ụ ủ ẽ ị ủ
phân thành các ph c hydroxyaluminum. Quá trình th y phân Alứ ủ 3+ s gi i phóng Hẽ ả + và sẽ
làm gi m pH dung d ch đt, tr khi có ngu n OHả ị ấ ừ ồ - trung hoà ion H+ này. M i b c th yỗ ướ ủ
phân ti p theo sau s x y ra m t pH cao h n b c tr c đó. Các ph n ng sau đây trìnhế ẽ ả ở ộ ơ ướ ướ ả ứ
bày s cân b ng gi a các d ng Al trong đt:ự ằ ữ ạ ấ
Al3+ + H2O Al(OH)2+ + H+
Al(OH)2+ + H2O Al(OH)2+ + H+
Al(OH)2+ + H2O Al(OH)30 + H+
Al(OH)30 + H2O Al(OH)4- + H+
N u thêm m t base vào trong đt, Hế ộ ấ + trong dung d ch đt s b trung hoà tr c tiên.ị ấ ẽ ị ướ
Khi ti p t c cho thêm base vào, Alế ụ 3+ s b th y phân, và s hình thành H+ v i hàm l ngẽ ị ủ ẽ ớ ượ
đng l ng v i hàm l ng Alươ ượ ớ ượ 3+ b th y phân. C n chú ý là Al(OH)3 không hoà tan và sị ủ ầ ẽ
k t t a pH >6.5, khi s n ph m hoà tan c a Al(OH)ế ủ ở ả ẩ ủ 3 v t quá m c cân b ng.ượ ứ ằ
T ng t nh Hươ ự ư 2O, Al3+ cũng là 1 ch t l ng tính, v a có tính acid v a có tính base,ấ ưỡ ừ ừ
nh trình bày trong các ph ng trình sau:ư ươ
Al là 1 base:
Al(OH)3 + H+ Al(OH)2+ + H2O
Al(OH)2+ (OH)2+ + H2O
4
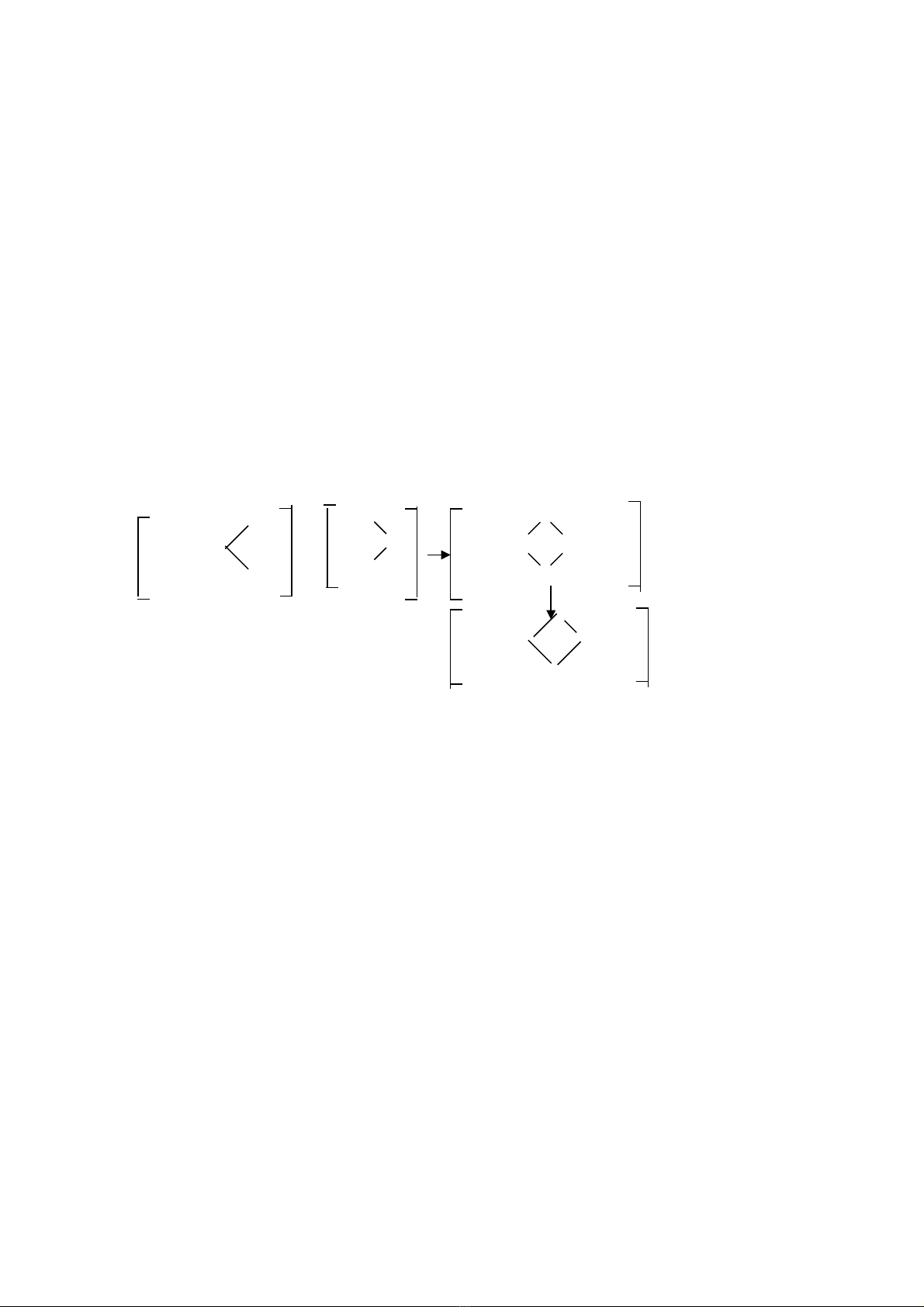
Al(OH)2+ + H+ Al3+ + H2O
Al(OH)3 + 3H+ Al3+ + 3H2O
Al là 1 acid:
Al3+ + OH- Al(OH)2+
Al(OH)2+ + OH- Al(OH)2+
Al(OH)2+ + OH- Al(OH)3
Al là 1 anion:
Al(OH)3 + OH- Al(OH)4-
Các ion hydroxyl nhôm k t h p v i nhau hình thành nên các polymers mang nhi uế ợ ớ ề
đi n tích khác nhau. Quá trình polymer hoá đc gia tăng khi có s hi n di n c a các bệ ượ ự ệ ệ ủ ề
m t khoáng sét. C ch hình thành các polymers là s chia s các nhóm OHặ ơ ế ự ẽ - trên các
khoáng v i các ion Alớ3+, nh trình bày trong các ph ng trình sau:ư ươ
Các polymer Al có đi n tích (+) chi m t l cao và ch y u là d ng không trao đi.ệ ế ỉ ệ ủ ế ạ ổ
CEC c a đt có th ch u nh h ng b i s h p ph c a các polymers mang đi n tích (+)ủ ấ ể ị ả ưở ở ự ấ ụ ủ ệ
này. pH cao, CEC tăng do Al(OH)Ở3 k t t a và gi m s hình thành polymer Al mang đi nế ủ ả ự ệ
tích (+) hay không có s hi n di n c a các polymer Al. Nh ng khi pH đt gi m s làm tăngự ệ ệ ủ ư ấ ả ẽ
s hình thành polymer mang đi n tích (+), nên làm gi m CEC c a đt.ự ệ ả ủ ấ
OH 2+ H2O 2+ OH 4+
(H2O)Al + Al(H2O)4 (H2O)4Al A l(H2O)4 +2H2O
H2O OH OH
O 2+
(H2O)4Al Al(H2O)4 +2H+
O
S th y phân Fe t ng t nh s th y phân Al nh trình bày trong ph ng trìnhự ủ ươ ự ư ự ủ ư ươ
sau. M c dù ph n ng th y phân Fe s gây chua cao h n s th y phân Al v m t nguyênặ ả ứ ủ ẽ ơ ự ủ ề ặ
lý, nh ng đ chua này đc đm b i các ph n ng th y phân c a Al. Vì v y, s ï th yư ộ ượ ệ ở ả ứ ủ ủ ậ ự ủ
phân c a Fe có nh h ng r t ít đn pH đt cho đn khi ph n l n Al trong đt b ph nủ ả ưở ấ ế ấ ế ầ ớ ấ ị ả
ng th y phân.ứ ủ
Fe3+ + H2O Fe(OH)2+ + H+
Các polymers Fe và Al có th hi n di n d i d ng các keo vô đnh hình hay tinhể ệ ệ ướ ạ ị
th , các keo này che ph các b m t sét và các khoáng khác. Chúng cũng có th đc giể ủ ề ặ ể ượ ữ
gi a các m ng l i c a các khoáng sét có tính tr ng n trong đt, ngăn c n s s p đữ ạ ướ ủ ươ ở ấ ả ự ụ ổ
c a các m ng l i này khi các khoáng b m t n c.ủ ạ ướ ị ấ ướ
3.1.4 Các mu i hoà tanố
Các mu i acid, mu i trung tính, hay mu i base trong dung d ch đt th ng phát sinhố ố ố ị ấ ườ
t s phong hoá c a khoáng, s phân gi i ch t h u c , hay do s bón phân hoá h c vàừ ự ủ ự ả ấ ữ ơ ự ọ
phân h u c c a con ng i. Các cations c a các mu i này s thay th các ion Alữ ơ ủ ườ ủ ố ẽ ế 3+ h p phấ ụ
trên đt chua và vì th làm gi m pH c a dung d ch đt (do Al b đy ra ngoài dung d ch). Vìấ ế ả ủ ị ấ ị ẩ ị
v y, khi bón các cations có hoá tr 2 vào đt s làm gi m pH dung d ch đt m nh h n soậ ị ấ ẽ ả ị ấ ạ ơ
v i các cation kim lo i có hoá tr 1 (do l c thay th Al c a các cation hoá tr 2 cao h nớ ạ ị ự ế ủ ị ơ
cation hoá tr 1).ị
Bón phân theo hàng s t o ra m t n ng đ mu i hoà tan cao trong vùng đt có bónẽ ạ ộ ồ ộ ố ấ
phân, nên s làm gi m pH dung d ch đt r t m nh ngay t i cùng đó do s th y phân c aẽ ả ị ấ ấ ạ ạ ự ủ ủ
5


























