
Chương IV: Lý thuyết cổ điển
về vật lý nguyên tử
1.MẪU NGUYÊN TỬ THOMSON.
-Tới thế kỉ XIX quan niệm về nguyên tử là
phần tử cuối cùng không phân li được do
Đêmôcrít đề xướng từ thế kỉ thứ V, trước
công nguyên đã không thể tồn tại được
nữa.
-Bởi vì ngay từ sự kiện khám phá ra các hạt electron (1897)
đã cho người ta nhận thấy rằng nguyên tử phải có những
thành phần và những cấu trúc nhất định.
-Năm 1904 nhà vật lý người Anh Thomson đã đưa ra mô
hình nguyên tử cụ thể đầu tiên. Nguyên tử có dạng hình cầu
với kích thước vào bậc Angstron (1Å=10-10 m). Tích điện
dương dưới dạng một môi trường đồng chất, còn các electron
thì phân bố rải rác và đối xứng bên trong hình cầu đó
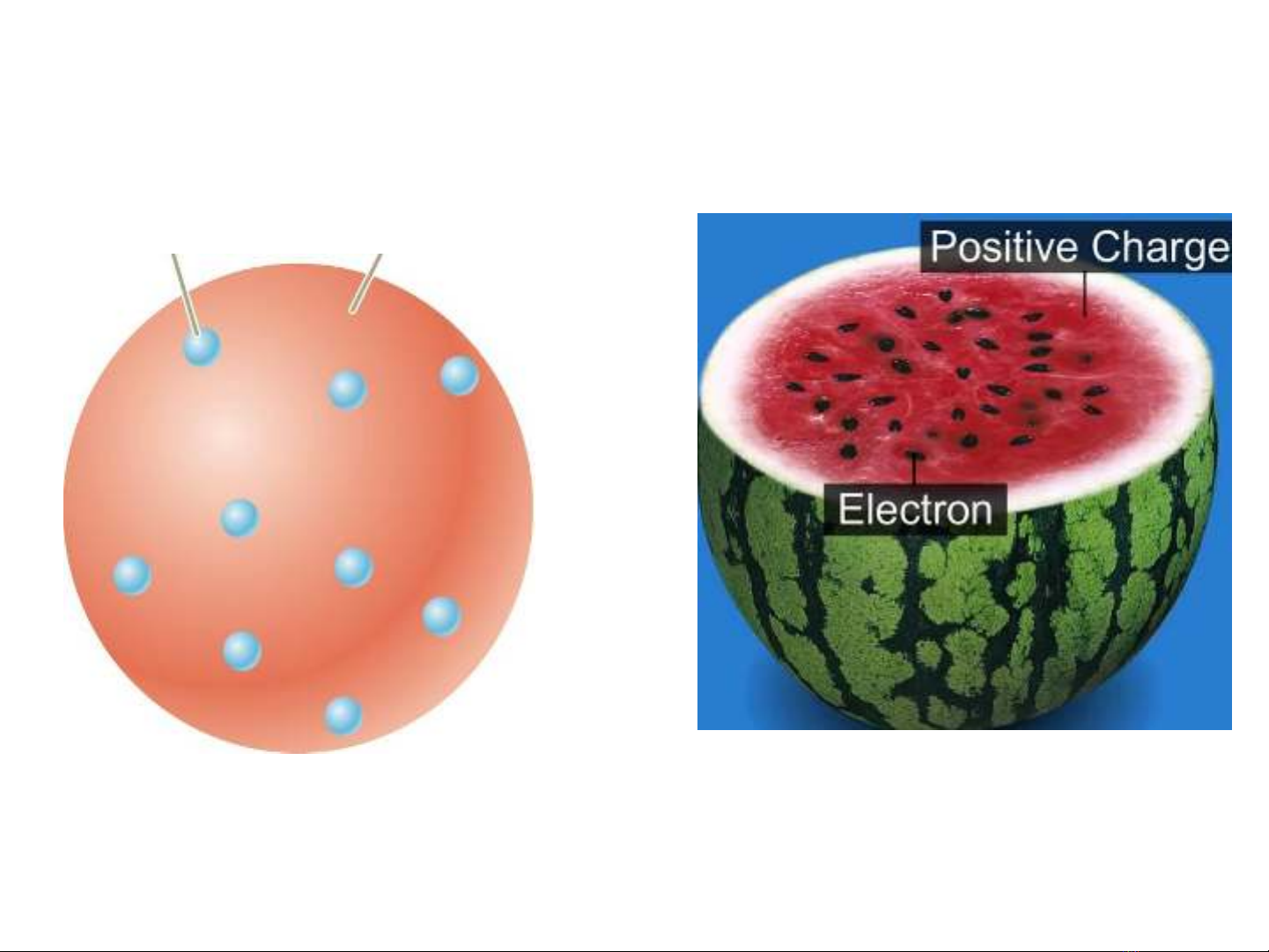
Môi trường đồng chất và
tích điện dương
Electron
=

oĐiện tích dương của môi trường và điện
tích âm của các electron bằng nhau để
đảm bảo tính trung hoà về điện của
nguyên tử.Mô hình này còn được gọi là
mẫu nguyên tử “bánh hạt nhân”.
o Trong thời gian dài mẫu nguyên tử của
Thomson có vẻ như hợp lý.Nhưng sau
bằng cách cho những hạt đi xuyên sâu
vào bên trong hạt nhân thì kết quả khác so
với đoán nhận lý thuyết theo mẫu
Thomson.
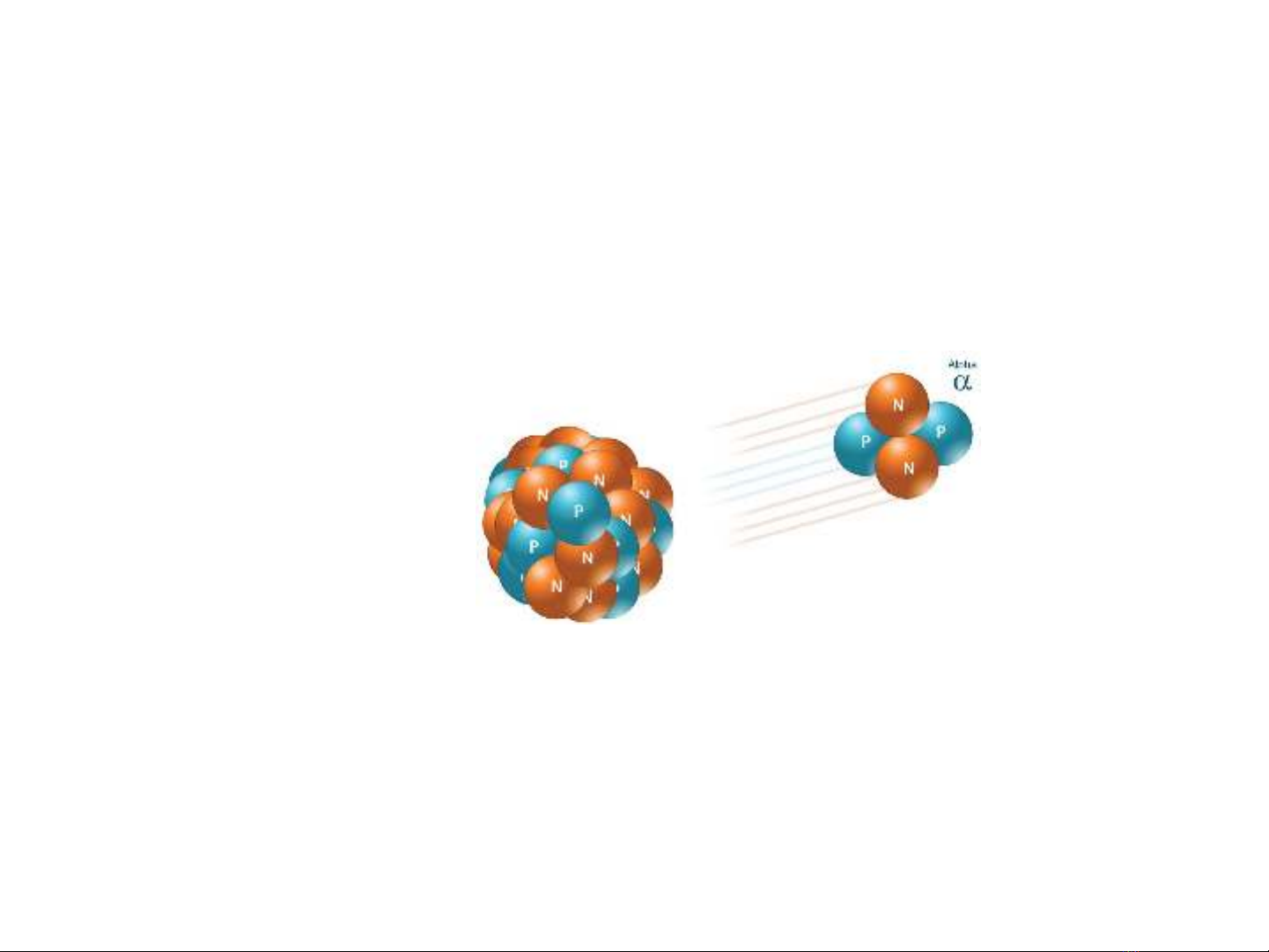
2. THÍ NGHIỆM RUTHERFORD VỀ TÁN XẠ HẠT α
- Chùm hạt α đi qua một khe hẹp đập vào một lá
vàng mỏng, phía sau lá vàng là màn huỳnh quang,
phủ lớp Sunfit kẽm nó cho ta một dấu hiệu loé
sáng khi có hạt alpha đập vào.
- Các nhà khoa học dùng một nguồn phóng xạ tự
nhiên phát ra chùm hạt alpha (α) có vận tốc lớn.
Các hạt này là các nguyên tố Helium đã mất 2
electron, vì vậy nó có điện tích (+2e)


![Bài giảng Vật lý đại cương và sinh lý [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250804/vijiraiya/135x160/88621754292979.jpg)


















![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)




