
S GIÁO D C & ĐÀO T O TUYÊN QUANGỞ Ụ Ạ
TR NG THPT ĐÔNG THƯỜ Ọ Đ KI M TRA GI A K IỀ Ể Ữ Ỳ
Môn: Hóa h c – ọL pớ 11
Th i gian làm bàiờ: 45 phút
Ti t 23:ế KI M TRA GI A K IỂ Ữ Ỳ
1. M C ĐÍCH KI M TRAỤ Ể
a) V ki n th c:ề ế ứ
- Nh n bi t ch t đi n li m nh, ch t đi n li y u.ậ ế ấ ệ ạ ấ ệ ế
- Vi t ph ng trình ph n ng trao đi trong dung d ch ch t đi n li.ế ươ ả ứ ổ ị ấ ệ
- Bi t đi u ki n đ x y ra ph n ng trao đi ion trong dung d ch các ch t đi nế ề ệ ể ả ả ứ ổ ị ấ ệ
li.
- Tính ch t c a ni t và cac h p ch t c a nit .ấ ủ ơ ợ ấ ủ ơ
b) V kĩ năng: ề
- Vi t ph ng trình đi n li.ế ươ ệ
- Gi i các bài t p tính pH dung d ch.ả ậ ị
- Vi t PTPU minh h a tính ch t c a nit và h p ch t c a nitế ọ ấ ủ ơ ợ ấ ủ ơ
c) V t duy thái đ: ề ư ộ
- Nghiêm túc.
2. HÌNH TH C Đ KI M TRAỨ Ề Ể
- Hình th c: Tr c nghi m + T lu nứ ắ ệ ự ậ
- H c sinh làm bài trên l pọ ớ
3. MA TR NẬ
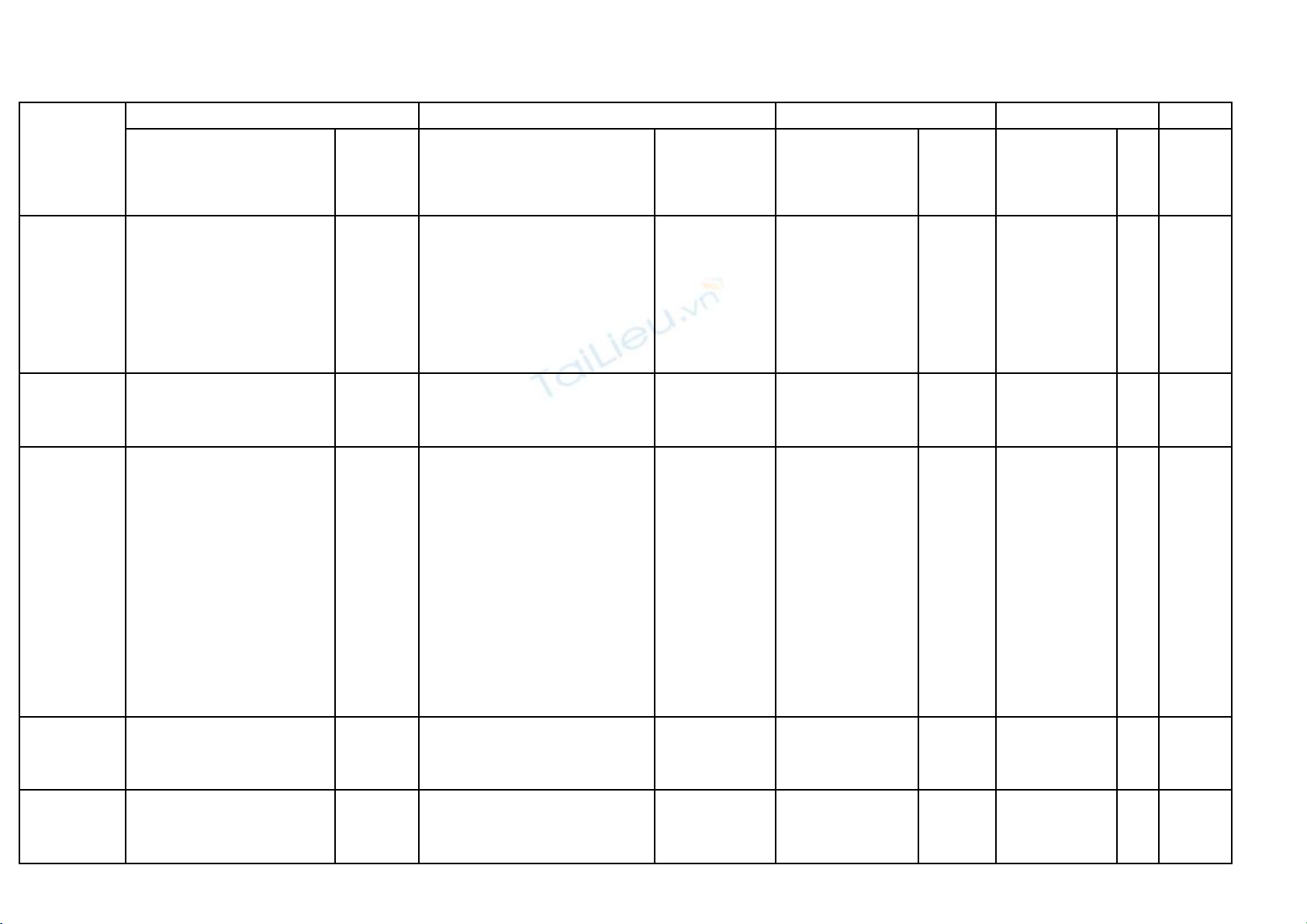
M c ứ
độ
Ch đủ ề
Nh n bi tậ ế Thông hi uểV n d ng th pậ ụ ấ V n d ng caoậ ụ T ngổ
TN TL TN TL TN TL TN TL
S đi n liự ệ -Nh n bi t ch t đi n li ậ ế ấ ệ
m nh, ch t đi n li y u.ạ ấ ệ ế
- Đnh nghĩa s đi n li.ị ự ệ
- Đnh nghĩa axit-bazo- ị
mu i.ố
- Xác đnh môi tr ng c a ị ườ ủ
dung d chị
- Hi u đi u ki n x y ra ể ề ệ ả
ph n ng trao đi ion trong ả ứ ổ
dung d ch ch t đi n liị ấ ệ
Vi t ph ngế ươ
trình ph n ả
ng, ph ngứ ươ
trình ion rút
g n.ọ
- Tính n ng đ ồ ộ
ion H+ Tính
pH c aủ
dung
d ch 1 ị
axit, 1
bazo
Tính pH
dung d ch ị
d ch sau ị
ph n ng ả ứ
trung hòa,
dung d ch ị
nhi u axitề
S câuố
S ố
đi mể
4
1 3 0,75 111
0,25 1220,5 12
5,5
Nit - Photơ
pho
(Đn h t ế ế
bài Axit
nitric,
mu i ố
nitrat)
- Nêu đc c u t oượ ấ ạ
nguyên t , phân t , tínhử ử
ch t v t lí, hóa h c,ấ ậ ọ
tr ng thái t nhiên, đi uạ ự ề
ch , ng d ng c a nitế ứ ụ ủ ơ
và h p ch t c a nit .ợ ấ ủ ơ
- Vi t đc ptp th hi nế ượ ư ể ệ
tchh c a nit và các h pủ ơ ợ
ch t c a nit .ấ ủ ơ
- Xác đnh đc vai trò c aị ượ ủ
các ch t trong m t ph nấ ộ ả
ng (oxi hóa kh ) c th .ứ ử ụ ể
- Gi i bài toánả
liên quan đnế
amoniac, mu iố
amoni, mu iố
nitrat.
- Gi iả
bài toán
ph nả
ngứ
c aủ
kim
lo iạ
v iớ
dung
d chị
HNO3.
- Gi i đc ả ượ
bài toán liên
quan đn ế
ph n ng ả ứ
đi u ch ề ế
amoniac, bài
toán KL v i ớ
HNO3.
S câuố
S ố
đi mể
6
1,5
2
0,5
1
0,25
1
2
1
0,25
11
4,
5
T ngổ10
2,5 5 1,25 1
1 20,5 243
0,75
23
10

4. Đ KI M TRAỀ Ể
Ph n Iầ: Tr c nghi m khách quan ( 5 đi m )ắ ệ ể
Ch t nào d i đây là axit theo A- rê-ni-ut?ấ ướ
A. Cr(NO3)3.B. HCl. C. Na2SO4.D. KOH.
[<br>]
Tr n 500ml dung d ch HCl 0,1M v i 500ml dung d ch NaOH 0,12M thu đc 1000ml dung d chộ ị ớ ị ượ ị
X. pH c a dung d ch X là: ủ ị
A. 13 B.12 C.11 D. 10
[<br>]
M t m u n c có pH = 5. V y n ng đ [ộ ẫ ướ ậ ồ ộ
] trong đó là:
A.10-3 MB. 1.
4
10
MC. 1,0.
5
10
M D. 1,0.
2
10
−
M
[<br>]
Dung d ch X g m HCl 0,002M, HNOị ồ 3 0,002, H2SO4 0,003M. pH c a dung d ch X: (Coi Hủ ị 2SO4
đi n li hoàn toàn)ệ
A. 2,5 B. 2 C. 3 d. 4
[<br>]
Nhom nào d i đây g m axit nhi u n c?ướ ồ ề ấ
A. H2S, HNO3 B. H2S, H3PO4.C. HClO4, H3PO4. D. HBr, H2SO4
[<br>]
Trong các ch t sau, ch t nào là ch t đi n li y u:ấ ấ ấ ệ ế
A. KCl B. HCl C. HF D. KOH
[<br>]
Môi tr ng axit là môi tr ng có pH:ườ ườ
A. <7 B. = 7 C. > 7 D.> 8
[<br>]
Ch t nào sau đây d n đc đi n ?ấ ẫ ượ ệ
A. N c c t.ướ ấ B. Ancol etylic. C. Dung d ch NaCl.ị D. NaCl(r).
[<br>]
Ph ng trình hóa h c nào d i đây vi t ươ ọ ướ ế không đúng?
A. Zn(NO3)2 + CuCl2
Cu(NO3)2 + ZnCl2.
B. Na2SO4 + BaCl2
BaSO4
+ 2NaCl.
C. 2HCl + Mg(OH)2
MgCl2 + 2H2O.
D. FeS + 2HCl
FeCl2 + H2S
.
[<br>]
Đi u ki n x y ra ph n ng trao đi ion trong dung d ch các ch t đi n li là:ề ệ ả ả ứ ổ ị ấ ệ
A. T o k t t aạ ế ủ B. T o ch t khíạ ấ
C. T o ch t đi n li y u.ạ ấ ệ ế D. Ít nh t m t trong ba đi u ki n trên.ấ ộ ề ệ
[<br>]
Ng i ta s n xu t khí nit trong công nghi p b ng cách nào d i đây?ườ ả ấ ơ ệ ằ ướ
A. Ch ng c t phân đo n không khí l ng.ư ấ ạ ỏ
B. Nhi t phân dung d ch NHệ ị 4NO2 bão hòa.
C. Dùng photpho đ đt cháy h t oxi không khí.ể ố ế
D. Cho không khí đi qua b t đng nung nóng.ộ ồ
[<br>]

Nh t t dung d ch NHỏ ừ ừ ị 3 cho đn d vào ng nghi m đng dung d ch CuSOế ư ố ệ ự ị 4. Hi n t ng quanệ ượ
sát đc làượ :
A. Dung d ch màu xanh chuy n sang màu xanh th m.ị ể ẫ
B. K t t a màu xanh lam t o thành.ế ủ ạ
C. Có k t t a màu xanh t o thành và có khí màu nâu đ thoát ra.ế ủ ạ ỏ
D. Lúc đu có k t t a màu xanh nh t, sau đó k t t a tan d n t o thành dung d ch màu xanhầ ế ủ ạ ế ủ ầ ạ ị
th m.ẫ
[<br>]
Cho NaOH t i d vào 200ml dung d ch NHớ ư ị 4Cl 1M. Sau khi ph n ng k t thúc thu đc V lít khíả ứ ế ượ
đktc. Giá tr c a V là:ở ị ủ
A. 2,24 B. 4,48 C. 8,96 D. 3,36
[<br>]
Đ t o đ x p cho m t s lo i bánh, có th dùng mu i nào sau đây:ể ạ ộ ố ộ ố ạ ể ố
A. (NH4)3PO4B. NH4HCO3
C. CaCO3 D. NaCl
[<br>]
Trong th c t HNOự ế 3 đc đc đ vào:ặ ượ ể
A. Bình th y trong su tủ ố B. Bình th y tinh s m màuủ ẫ
C. Bình nh aựD. C c không đy n pố ạ ắ
[<br>]
S oxi hóa c a nit trong HNOố ủ ơ 3 là:
A. +3 B. +5 C. +1 D. -3
[<br>]
Kim lo i nào sau đây th đng v i HNOạ ụ ộ ớ 3 đc ngu i:ặ ộ
A. Fe B. Cu C. Zn D. Ag
[<br>]
Mu i nitrat có ch a trong thành ph n thu c n đen:ố ứ ầ ố ổ
A. AlCl3B. KNO3 C. NaCl D. KCl
[<br>]
Nhi t phân Cu(NOệ3)2 thu đc s n ph m là:ượ ả ẩ
A. Cu(NO2)2, NO2. B. CuO, NO2, O2.
C. Cu, NO2, O2. D. CuO, NO2.
[<br>]
Dung d ch amoniac làm qu tím chuy n thành màu:ị ỳ ể
A. Xanh
B. Đỏ
C. Vàng
D. Không đi màu.ổ
[<br>]
Ph n t lu n: (5 đi m)ầ ự ậ ể
Câu 21(1 đi m):ể Vi t ph ng trình phân t , PT ion đu đ, ph ng trình ion rút g n c a cácế ươ ử ầ ủ ươ ọ ủ
ph n ng sau:ả ứ
a, KOH + HCl
b, FeCl3 + NaOH
Câu 22( 2 đi m): ểTính pH c a các dung d ch sauủ ị
a. HCl 0,001M

b. Ba(OH)2 0,01 M
Câu 23.1: ( Dành 11B1):
Cho 30,4g gam h n h p Fe và Cu tác d ng v i dung d ch HNOỗ ợ ụ ớ ị 3 loãng v a đ th y thoát raừ ủ ấ
8,96 lit khí NO (đktc) duy nh t.ấ
a. Tính thành ph n ph n trăm kh i l ng m i kim lo i trong h n h p ban đu ầ ầ ố ượ ỗ ạ ỗ ợ ầ
b. Tính th tích dung d ch HNOể ị 3 1M c n dùng.ầ
c. Tính kh i l ng mu i thu đc sau ph n ngố ượ ố ượ ả ứ
Câu 23.2: ( Dành cho 11B234567)
Cho 16,8 gam Fe tác d ng v i dung d ch HNOụ ớ ị 3 loãng v a đ th y thoát ra V lit khí NO ừ ủ ấ
(đktc) duy nh t.ấ
b. Tính V
b. Tính th tích dung d ch HNOể ị 3 1M c n dùng.ầ
d. Tính kh i l ng mu i thu đc sau ph n ngố ượ ố ượ ả ứ
ĐÁP ÁN PH N T LU NẦ Ự Ậ
Câu Đáp ánĐi mể
Câu 21
a, KOH + HCl
KCl + H2O
PT ion đy đ: Kầ ủ + + OH- + H+ + Cl-
K+ + Cl- + H2O
Ph ng trình ion rút g n: Hươ ọ + + OH-
H2O
b, FeCl3 + 3NaOH
Fe(OH)3 + 3NaCl
Ph ng trình ion đy đ:ươ ầ ủ
Fe3+ + 3Cl- + 3Na++3OH-
Fe(OH)3 + 3Na++3Cl-
PT ion rút g n là: Feọ3+ + 3OH-
Fe(OH)3
0,5
0,5
Câu 22 Tính pH c a các dung d ch sauủ ị
a. HCl 0,001M
HCl
H+ + Cl-
0,001 M
0,001M
Theo ph ng trình : [Hươ +]=0,001M
pH=3
b. Ba(OH)2 0,0005M
Ba(OH)2
Ba2+ + 2OH-
0,01M
0,02M
Theo pt :[OH-]=0,02M
[H+]=5.10-13M
pH= 12,3
1,0
1,0
Câu 23 Câu 23.1
a. G i s mol c a Fe,Cu l m l t là:x,y ọ ố ủ ầ ượ
Ta có: 56x+64y=30,4 (I)
Fe + 4HNO3
Fe(NO3)3 + NO + 2H2O
x mol
x
3Cu + 8HNO3
3Cu(NO3)2 + 2NO + 4H2O
y mol
3/2y
Theo PT ta có x+3/2y= 0,4 (II)
0,25
0,25
0,25












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



