TRƯỜNG THPT TRẦN QUỐC TUẤN ĐỀ KIỂM TRA GIỮA HỌC KỲ 1
TỔ:HÓA NĂM HỌC: 2023 - 2024
Môn: HÓA Lớp: 11C1,2,3,4,5
(Đề kiểm tra có 3 trang) Ngày kiểm tra:
Thời gian: 45 phút (không kể thời gian giao đề)
Họ, tên học sinh: ……………….…..………
Số báo danh: ………………………...……..
Lớp:................................................................
Học sinh được xem bảng tuần hoàn nguyên tố hoá học
I. PHẦN TRẮC NGHIỆM(7 ĐIỂM)
Câu 1: Số oxi hóa của nguyên tử nitrogen trong hợp chất HNO3?
A. +5. B. +4. C. +2. D. -2.
Câu 2: Trong các chất sau, chất nào là chất điện li yếu?
A. HCl. B. CH3COOH. C. NaOH. D. NaCl.
Câu 3: Theo thuyết của Bronsted – Lowry thì acid là chất
A. tan trong nước phân li ra OH-.B. cho proton.
C. nhận proton. D. tan trong nước phân li ra H+.
Câu 4: Cho cân bằng hoá học sau: CO2 (g) + H2 (g) CO (g) + H2O (g)
0
298
0
r
H
∆ >
. Yếu tố không
làm cân bằng trên chuyển dịch là
A. nồng độ khí H2.B. nồng độ khí CO.
C. áp suất chung của hệ. D. nhiệt độ.
Câu 5: Ở nhiệt độ cao, nitrogen thể hiện tính khử khi phản ứng với đơn chất nào sau đây?
A. Mg. B. O2.C. Ca. D. H2.
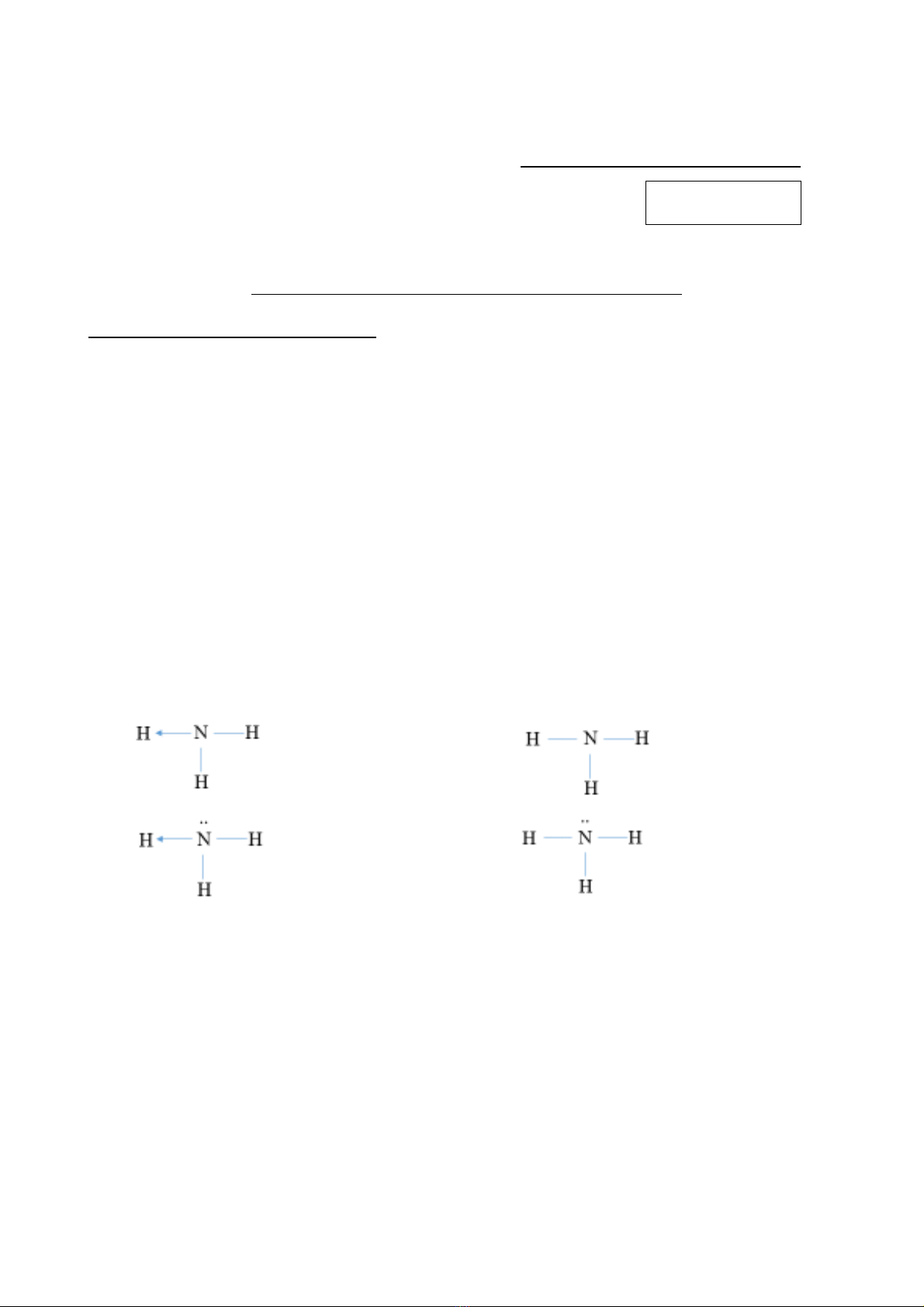
Câu 6: Công thức Lewis của phân tử ammonia là
A. .B. .
C. .D. .
Câu 7: Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm, thấy
thoát ra một chất khí. Chất khí đó là
A. NO2.B. NO. C. NH3.D. H2.
Câu 8: Dung dịch chất nào sau đây làm phenolphtalein chuyển sang màu hồng?
A. NaCl. B. HCl. C. KOH. D. HNO3.
Câu 9: X là một oxide của nitrogen, là chất khí, có màu nâu đỏ. Vậy X là
A. NO2B. N2O4.C. NO D. N2O5
Câu 10: Phát biểu nào dưới đây chưa chính xác?
A. Môi trường axit có pH < 7. B. Môi trường kiềm có pH > 7.
C. Môi trường kiềm có pH < 7. D. Môi trường trung tính có pH = 7.
Câu 11: Giá trị hằng số cân bằng KC của phản ứng thay đổi khi
A. thay đổi nồng độ các chất. B. thêm chất xúc tác.
C. thay đổi áp suất. D. thay đổi nhiệt độ.
Trang 1/3 - Mã đề thi 111
Mã đề: 111






































