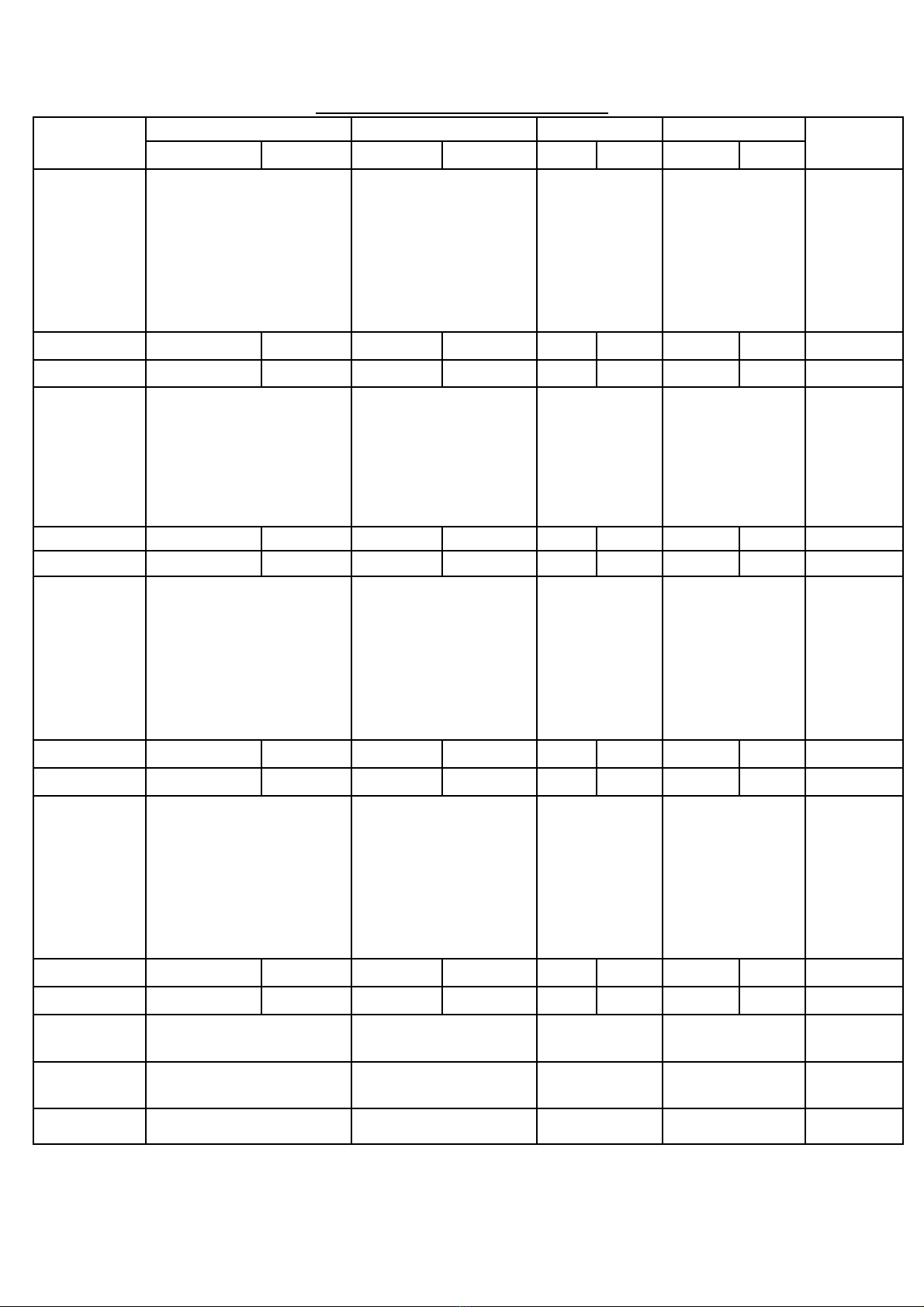
MA TRẬN ĐỀ KIỂM TRA
Tên chủ đề Nhận biết Thông hiểu Vận dụng Vận dụng cao Cộng
TN TL TN TL TN TL TN TL
Chủ đề 1
OXIT
(3 tiết)
- Biết tính chất hoá học
của oxit.
- Biết oxit gồm mấy
loại.
- Biết ứng dụng và
phương pháp sản xuất
một số oxit quan trọng.
Xác định công
thức hoá học
của oxit.
Số câu 4 1 5 câu
Số điểm 1,3đ 1đ 2,3 điểm
Chủ đề 2
AXIT
(4 tiết)
- Viết được PTHH
thể hiện tính chất
hoá học của axit
- Biết sử dụng thuốc
thử để nhận biết
muối sunfat.
Làm bài tập
tính theo
PTHH
Số câu 3 1 4 câu
Số điểm 1đ 2đ 3 điểm
Chủ đề 3
BAZƠ
(2 tiết)
- Biết tính chất hoá học
của bazơ.
- Biết tính chất, ứng
dụng của một số bazơ
quan trọng.
- Biết ý nghĩa thang
pH.
Số câu 6 6 câu
Số điểm 2đ 2 điểm
Chủ đề 4
MUỐI
PHÂN
BÓN HOÁ
HỌC
(3 tiết)
- Biết tính chất hoá học
của muối.
- Biết điều kiện xảy ra
phản ứng trao đổi.
Phân biệt được phân
bón đơn, phân bón
kép.
Số câu 2 1 3 câu
Số điểm 0,7đ 2đ 2,7 điểm
Tổng số
câu
12 câu 4 câu 1 câu 1 câu 18 câu
Tổng số
điểm
4 điểm 3 điểm 2 điểm 1 điểm 10 điểm
Tỉ lệ 40% 30% 20% 10% 100%








































