Trang 1/3 - Mã đề thi 132
SỞ GD-ĐT QUẢNG TRỊ ĐỀ KIỂM TRA GIỮA HỌC KỲ I NĂM HỌC 2021-2022
TRƯỜNG THPT THỊ XÃ QUẢNG TRỊ Môn: HOÁ Lớp: 11
Thời gian làm bài:45 phút, không kể thời gian giao đề
Họ và tên học sinh:……………………………………………….……………. Lớp: 11A……
I. Phần I: TNKQ (7 điểm)
Câu 1: Dung dịch H2SO4 0,0005 M có pH là
A. 3. B. 4. C. 2. D. 1.
Câu 2: Dung dịch chất nào sau đây có pH > 7?
A. NaNO3. B. CH3COOH. C. Ba(OH)2. D. K2SO4.
Câu 3: Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2?
A. Na2SO4. B. NaCl. C. HCl. D. K2SO4.
Câu 4: Chất nào sau đây là hiđroxít lưỡng tính?
A. Al(OH)3. B. KOH. C. Fe(OH)2. D. Ba(OH)2.
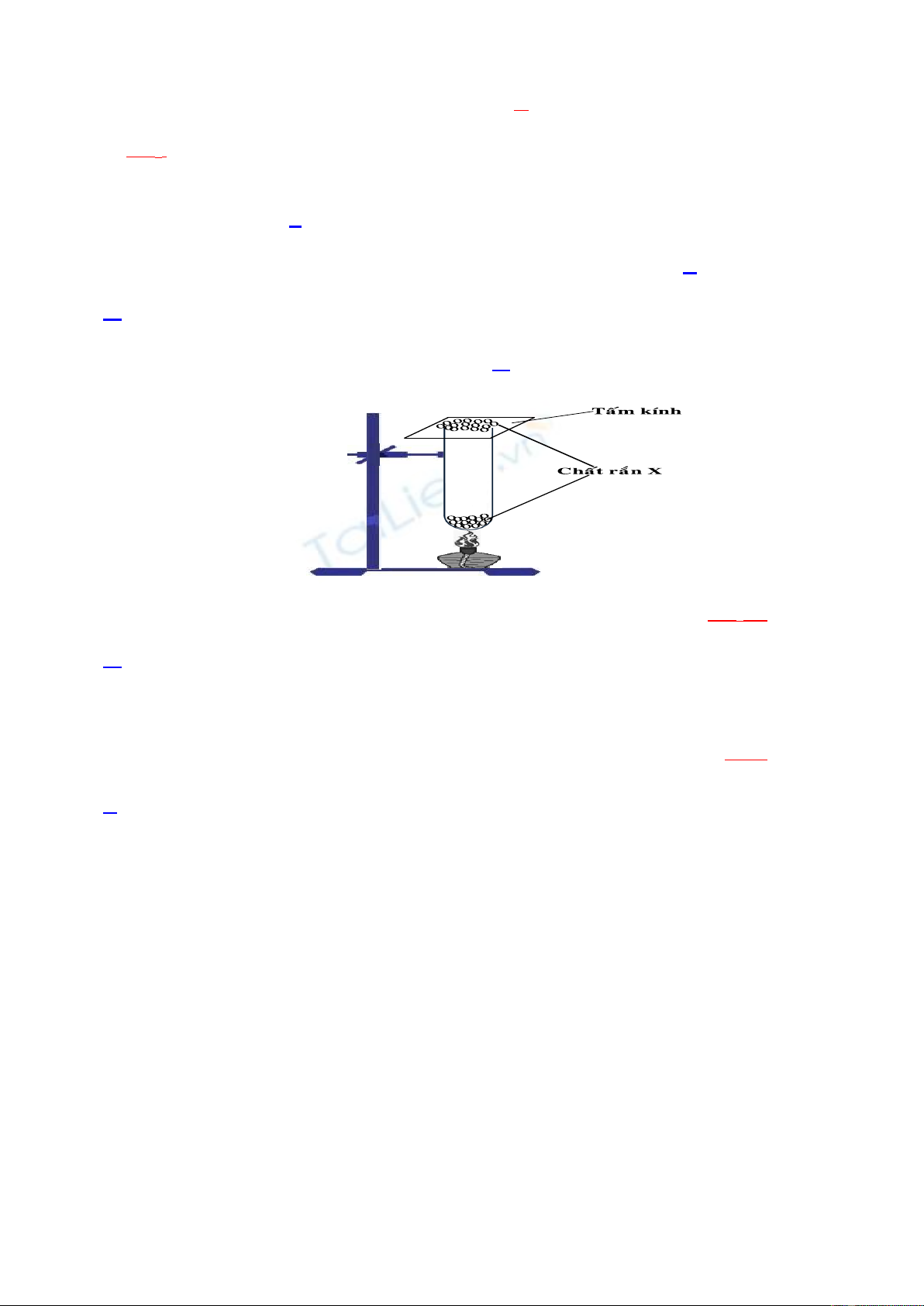
Câu 5: Nhúng 2 đũa thuỷ tinh vào 2 bình đựng dung dịch HCl đặc và NH3 đặc. Sau đó đưa 2 đũa
lại gần nhau thì thấy xuất hiện
A. khói màu tím. B. khói màu trắng. C. khói màu nâu. D. khói màu vàng.
Câu 6: Trộn dung dịch NaOH với dung dịch HCl, sau phản ứng thu được dung dịch X có pH < 7.
Chất tan có trong dung dịch X là
A. NaCl và H2O. B. NaCl, HCl. C. NaCl và NaOH. D. NaCl.
Câu 7: Ở điều kiện thường khí X không màu, kết hợp ngay với O2 trong không khí tạo ra khí NO2
có màu nâu đỏ. Công thức của khí X là
A. N2O. B. NO. C. N2. D. N2O5.
Câu 8: Số oxi hóa của nitơ trong N2O là
A. +2. B. +1. C. +4. D. +5.
Câu 9: Amoniac không có tính chất vật lí nào sau đây?
A. Tan tốt trong nước. B. Chất khí không màu.
C. Không tan trong nước. D. Có mùi khai và sốc.
Câu 10: Cho vài giọt phenolphtalein vào dung dịch NH3 thì dung dịch chuyển thành
A. màu xanh. B. màu cam. C. màu vàng. D. màu hồng.
Câu 11: Các dung dịch bazơ đều có một số tính chất chung, đó là tính chất của anion nào sau đây?
A. H+. B. NO3-. C. Cl-. D. OH-.
Câu 12: Muối nào sau đây dễ hòa tan trong nước?
A. BaSO4. B. NH4NO3. C. AgCl. D. CaCO3.
Câu 13: Cặp chất nào sau đây không cùng tồn tại trong dung dịch?
A. FeCl3 và NaNO3. B. Cu(NO3)2 và H2SO4.C. NaOH và Na2CO3. D. CuSO4 và NaOH.
Câu 14: Chất nào sau đây là muối trung hòa?
A. NaHCO3. B. NaHS. C. NaNO3. D. KHSO3.
Câu 15: Tên gọi của muối NH4Cl là
A. amoni clorua. B. amoni clorat. C. amoni sunfat. D. amoni cacbonat.
Câu 16: Công thức của khí amoniac là
A. N2. B. NH3. C. NO. D. NH2
Câu 17: Phương trình điện li nào sau đây không đúng?
A. Al(NO3)3
Al3+ + 3NO3- B. Na2SO4
2Na+ + SO42-
C. HNO3
H+ + NO3- D. Na3PO4
3Na+ + PO42-
Câu 18: Cho các chất sau: (NH4)2SO3, NaHCO3, Zn(OH)2, Na2CO3. Số chất vừa tác dụng với
dung dịch HCl, vừa tác dụng với dung dịch NaOH là
A. 1. B. 2. C. 4. D. 3.
Đề KT chính thức
(Đề có 02 trang)
Mã đề: 132