Nội
dung
kiến
thức
Mức độ
nhận
thức Cộng
Nhận biết Thông hiểu Vận dụng Vận dụng cao
TNKQ TL TNKQ TL TNKQ TL TNKQ TL
Chủ đề
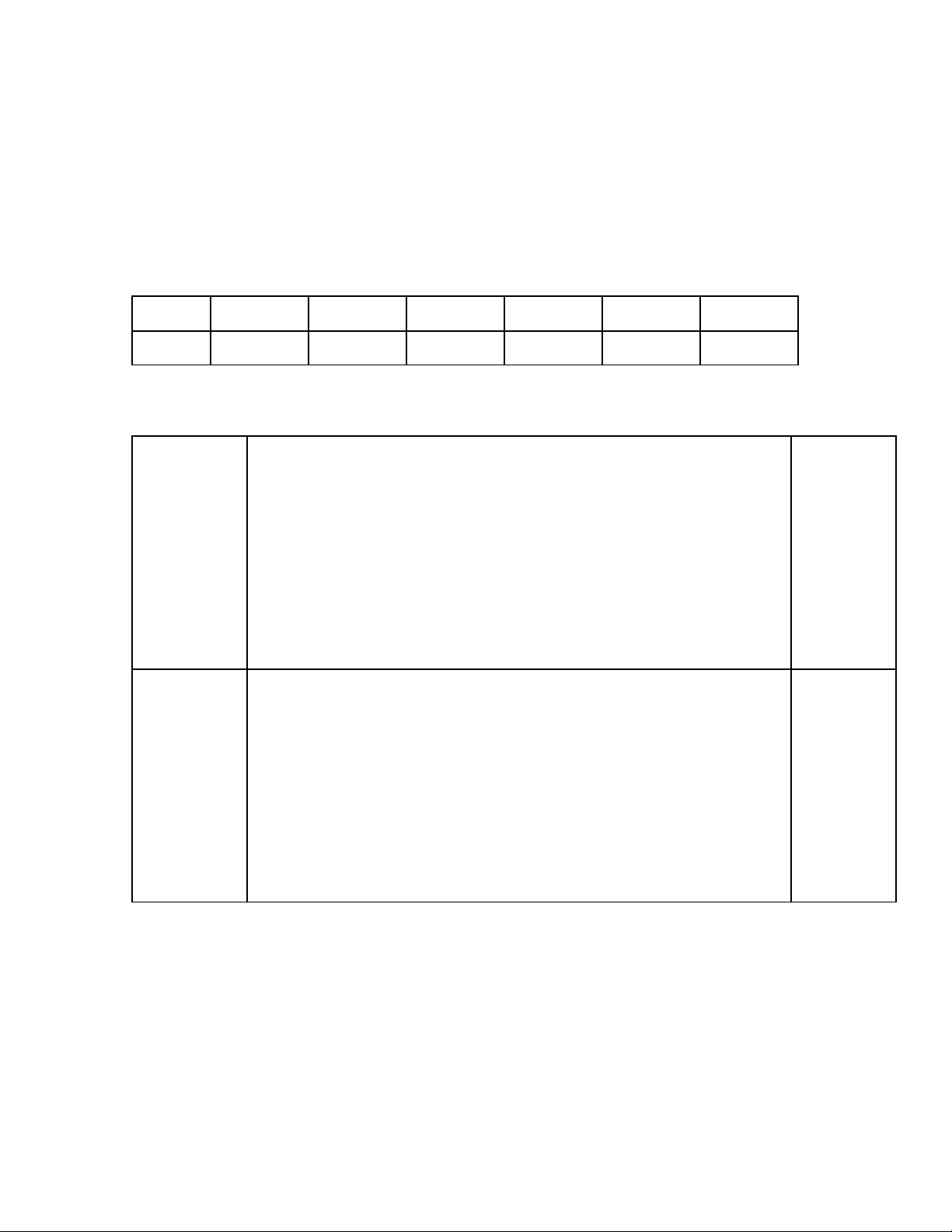
OXIT
- Nhận biết tính
chất hóa học của
oxit. Ứng dụng
của oxit
Viết PTHH
điều chế SO2
trong phòng thí
nghiệm
Số câu
Số
điểm
2 câu
1,0đ
1 câu
1,0đ
3 câu
2,0đ
Chủ đề
AXIT
- Nhận biết tính
chất hóa học của
axit
Bài tập tính
theo PTHH
Số câu
Số
điểm
2 câu
1,0đ
1 câu
2,0đ
3 câu
3,0đ
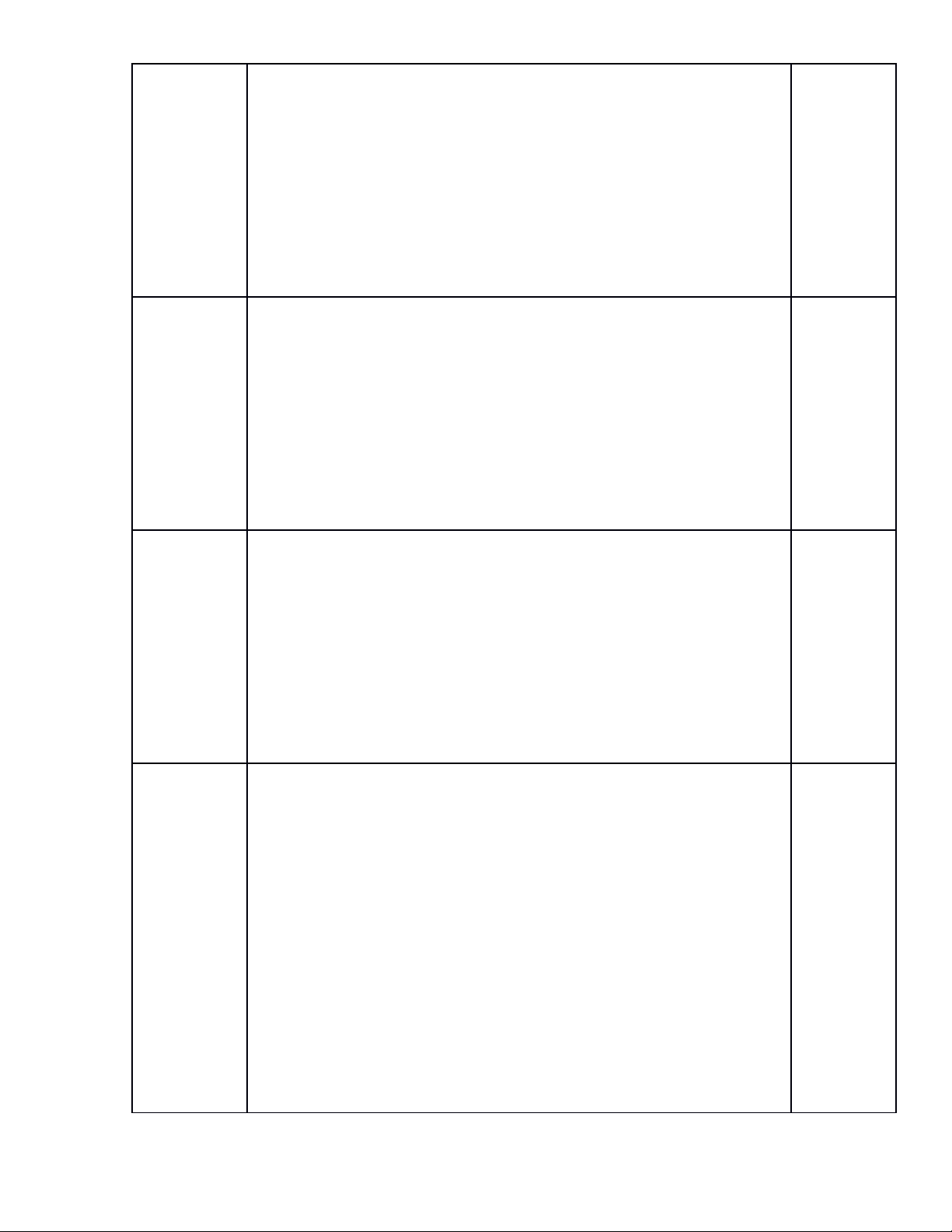
Chủ đề
BAZƠ
Nhận biết tính
chất hóa học của
bazơ
Nêu tính chất
hóa học của
bazơ tan và
viết PTHH
minh họa
Số câu
Số
điểm
1 câu
0,5đ
1 câu
2,0đ
2 câu
2,5đ
Chủ đề
MUỐI
Nhận biết tính
chất hóa học của
muối và nêu được
một số ứng dụng
của muối NaCl.
Giải thích hiện
tượng hóa học
Số câu
Số
điểm
1 câu
0,5đ
1 câu
1,0đ
1 câu
1,0đ
3 câu
2,5đ
T/ số câu hỏi
Tổng số điểm
7 câu
4,0đ
2 câu
3,0đ
1câu
2,0đ
1 câu
1,0đ
11 câu
10 đ