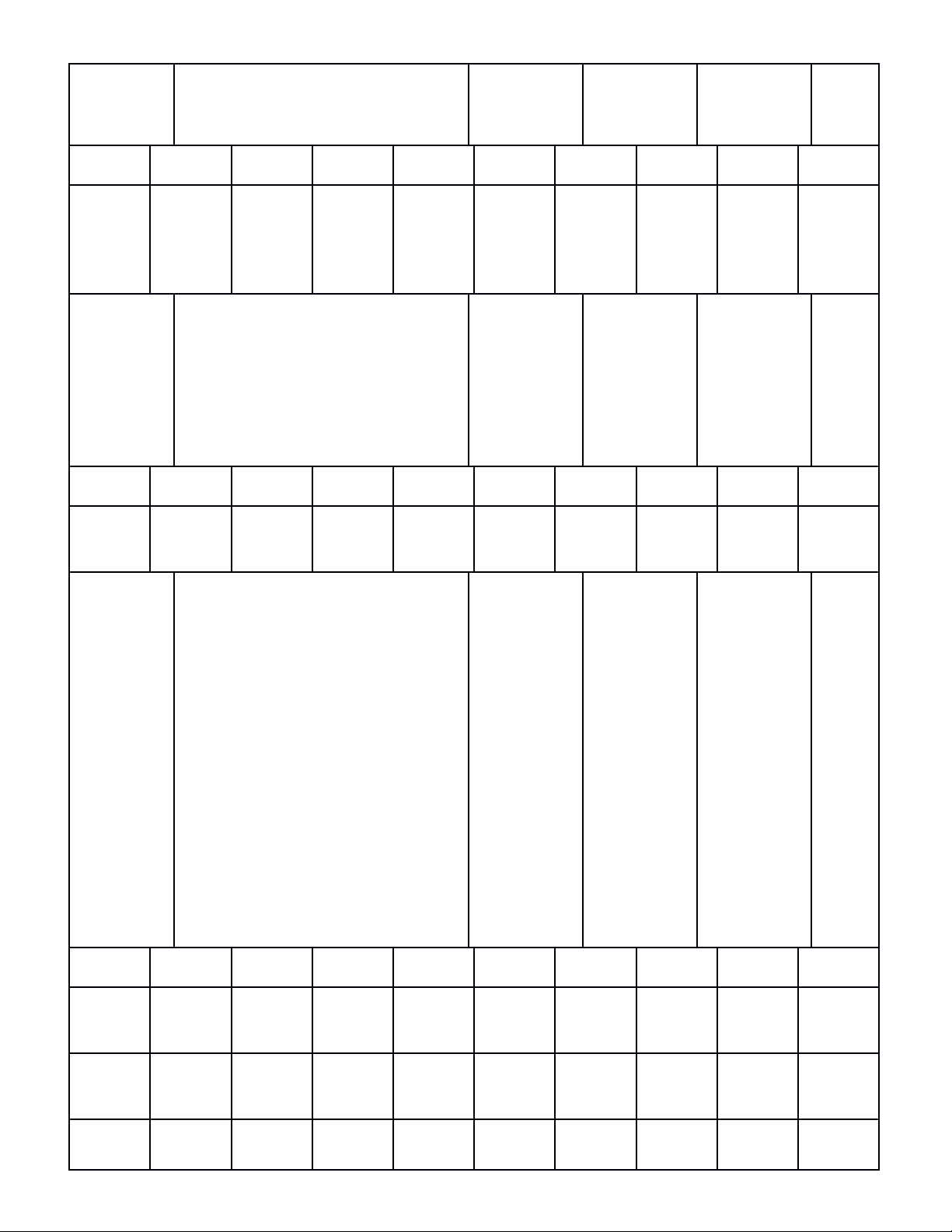
MA TRẬN KIỂM TRA GIỮA HỌC KÌ I NĂM HỌC 2023-2024
Môn: HÓA HỌC - LỚP 9
Tên chủ
đề
(nội dung,
chương…
)
Nhận biết Thông
hiểu
Vận dụng Vận dụng
cao
Cộng
TNKQ TL TNKQ TL TNKQ TL TNKQ TL
Chủ đề 1:
Oxit
- Khái niệm oxit, oxit axit, oxit
bazo
- Oxit quan trọng
- Tính chất hoá học của oxit
-Tính chất
hóa học của
oxit
- Hiểu
cách phân
loại oxit
Số câu 4 1 5
Số
điểm
1.33 đ 0.33đ 1.67đ
Chủ đề
2: Axit
- Khái niệm axit
- Tính chất hóa học chung của
axit
- Tính chất
hóa học của
H2SO4đặc
- phản ứng
của học
của axit
HCl, H2SO4
loãng
- Vận dụng
tính chất hóa
học của axit
để giải bài
toán, tính số
mol, khối
lượng, thể
tích dung
dịch, nồng
độ dung dịch
Số câu 1 1 1 3
Số
điểm
0.33đ 0.33đ 2đ 2.67đ
Chủ đề
3: Bazơ
- Khái niệm bazo
- Tính chất hóa học của bazo
- Nhận biết
bazo có
chứa Ba