
PHÒNG GDĐT TP THÁI NGUYÊN
TRƯỜNG THCS PHÚC TRÌU
Họ và tên: ...............................................
Lớp: ............
ĐỀ KIỂM TRA CUỐI HỌC KỲ I
Nămhọc 2021 - 2022
Môn: Hóahọc 9
(Thờigianlàmbài 45 phút)
Điểm NhậnxétcủaThầy, Côgiáo
Đềbài
I. TRẮC NGHIỆM. (3,0 điểm)Khoanhvàochữcáiđứngtrướccâutrảlờiđúng.
Câu 1.Dãy kim loại đươ3c să6p xê6p theo chiê8u hoa3t đô3ng ho6a ho3c giảm dần:
A. K, Al, Fe, Cu B. Al, Cu, Fe, K
C. Cu, Fe, Al, K D. K, Fe, Cu, Al
Câu 2. Clo là chất khí có màu
A. nâu đỏ B. vàng lục
C. lục nhạt D. trắng xanh
Câu 3: Nướcclolà dung dịchhỗnhợpcácchấtnào?
A. HCl; HClO. B. HCl; HClO2; Cl2.
C. NaCl; NaClO. D. HCl; HClO; Cl2.
Câu 4. Chấtnàodướiđâykhôngtácdụngvới Fe?
A. HCl. B. H2SO4 loãng.
C. H2SO4 đặc, nóng. D. H2SO4 đặc, nguội.
Câu 5.Biệnphápnàosauđâykhônglàmgiảmsựănmòncủakimloại?

A. Bôidầu, mỡlênbềmặtkimloại
B. Sơn, mạlênbềmặtkimloại
C. Đểđồvậtnơikhôráo, thoángmát
D. Ngâmkimloạitrongnướcmuốimộtthờigian
Câu 6. Do có tính hấp phụ, nên cacbon vô định hình được dùng để
A. làmđiện cực, chất khử
B. làmruột bút chì, chất bôi trơn
C. làmtrắng đường, mặt nạ phòng hơi độc
D. làmmũi khoan, dao cắt kính
II. TỰ LUẬN. (7,0 điểm)
Câu 1. (2,0 điểm) Hoàn thành sơ đồ phản ứng hóa học sau:
S → SO2 → SO3 → H2SO4 (loãng) → FeSO4
Câu 2.(1,0 điểm) Nêu, giảithíchhiệntượngvàviếtphươngtrìnhhóahọcxảy ra trongthínghiệm:
Ngâmmộtđoạndâyđồngtrong dung dịchbạcnitrat.
Câu 3. (2,0 điểm) Có 4 lọ mất nhãn chứa 4 dung dịch HCl, K2SO4, KCl, Ba(OH)2. Chỉ dùng quỳ tím, hãyxác định
các dung dịch trên.
Câu 4. (2,0 điểm) Cho 17,7 gam hỗn hợp haikimloại gồm Zn và Fe tác dụngvừađủ với dung dịch H2SO4, thu được
6,72 lít khí (đktc) và dung dịch Y.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại có trong hỗn hợp ban đầu.
Bàilàm
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………

……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
PHÒNG GDĐT TP THÁI NGUYÊN
TRƯỜNG THCS PHÚC TRÌU
HƯỚNG DẪN CHẤM
KIỂM TRA CUỐI HỌC KÌ I NĂM HỌC 2021-2022
Môn: Hóahọc 9
I. TRẮC NGHIỆM (3,0 điểm):
Học sinhchọnđúngmỗicâuđạt 0,5đ
Câu 1 2 3 4 5 6
Đápán A B A D D C
II. TỰ LUẬN (7,0 điểm):
Câ
u
Đáp án Điểm
1Phương trìnhphảnứng:
(1) S + O2 → SO2
(2) 2SO2 + O2 → 2SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 + Fe → FeSO4 + H2
0,5đ
0,5đ
0,5đ
0,5đ
2Hiệntượng:Cókimloạimàuxámbámngoàidâyđồng. Dung dịch ban
đầukhôngmàuchuyểndần sang màuxanh
Giảithíchhiệntượng:Đồngđẩybạc ra khỏi dung
dịchmuốibạcnitrattạothànhkimloạibạcbámngoàidâyđồng. Dung
0.25đ
0.25đ
dịchmàuxanhđượchìnhthànhlàmàucủamuốiđồng II nitrat.
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag 0,5đ
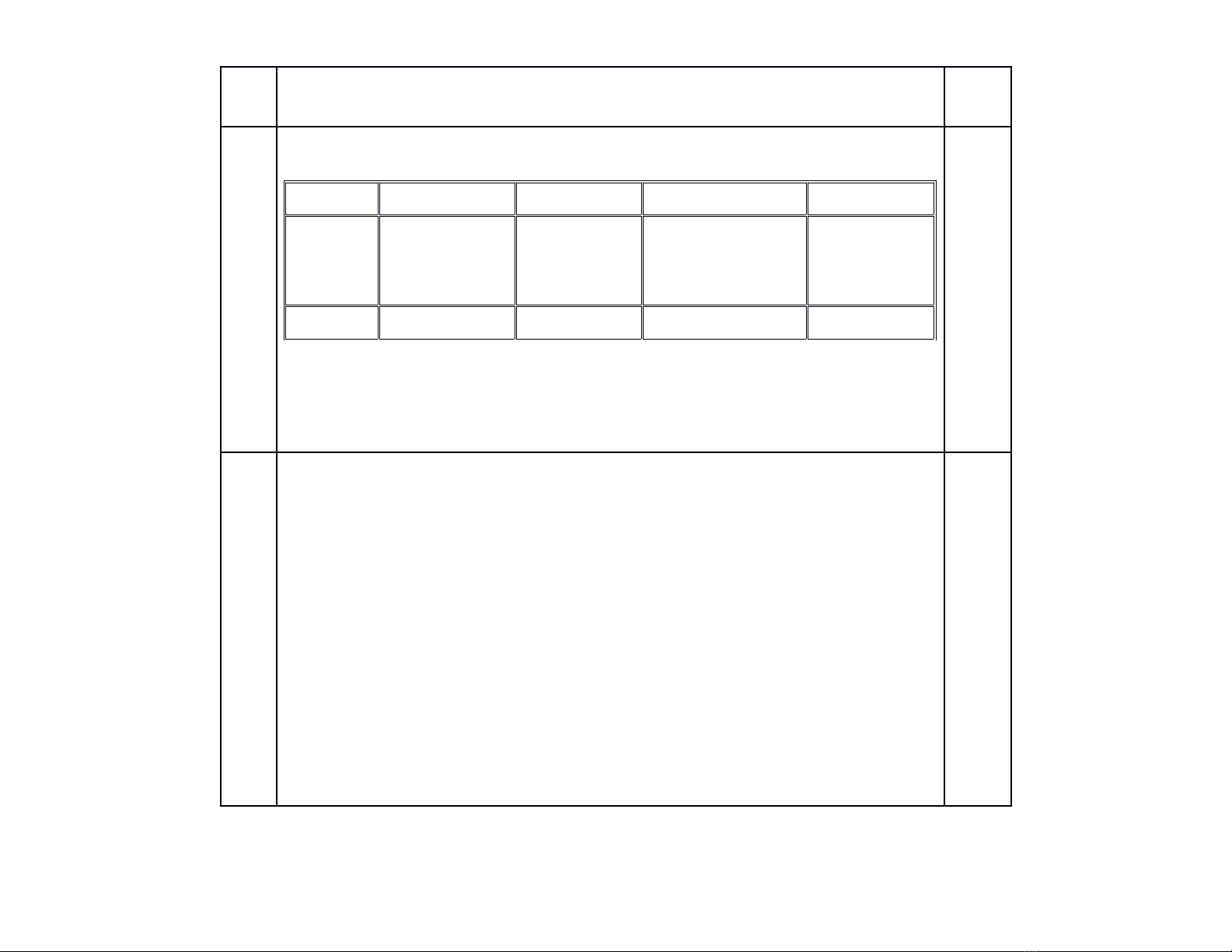
3Trích mẫu thuốc thử và đánh số thứ tự:
HCl K2SO4KCl Ba(OH)2
Quỳ tím Quỳ chuyển
sang màu đỏ
Quỳ không
chuyển màu
Quỳ không
chuyển màu
Quỳ chuyển
sang màu
xanh
Ba(OH)2- Kết tủa trắng Khônghiệntượng -
Dấu (-) đã nhận biết được
Phương trình phản ứng xảy ra:
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
0,5đ
1,0đ
0,5đ
4a) Phương trình hóa học: Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4 → FeSO4 + H2 (2)
b) nH2 = 0,3 mol
Gọi x, y lần lượt là số mol của Zn, Fe
Theo đề bài ta có:
65x + 56y = 17,7 (3)
Dựa vào phương trình (1), (2) ta có: x + y = 0,3 (4)
Giải hệ phương trình (3) và (4) ta được: x = 0,1; y = 0,2
mZn = 65.0,1 = 6,5 gam => %mZn = (6,5/17,7).100 = 36,72%
%mFe = 100% - 36,72% = 63,28 %
0,5đ
1,0đ
0,5đ












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



