
SỞ GIÁO DỤC VÀ ĐÀO TẠO
THÀNH PHỐ HỒ CHÍ MINH
TRƯỜNG THPT BÌNH CHIỂU
ĐỀ KIỂM TRA HỌC KÌ 2
NĂM HỌC 2020 – 2021
Môn: Hóa học 10
Thời gian làm bài : 45 phút
(không kể thời gian phát đề)
ĐỀ CHÍNH THỨC
Câu 1 (2,0 điểm). Hoàn thành chuỗi phản ứng sau (ghi rõ điều kiện nếu có):
(1) (2) (3) (4)
2 2 3 2 4
S SO Na SO Na SO NaOH
Câu 2 (1,0 điểm). Hoàn thành các phương trình phản ứng sau (ghi rõ điều kiện nếu có):
a) P + H2SO4 (đặc)
0
t
H3PO4 + SO2 + ?
b) FeO + H2SO4 (đặc)
0
t
? + SO2 + ?
Câu 3 (1,0 điểm). Nêu hiện tượng quan sát được và viết phương trình hóa học xảy ra khi:
a) Cho dung dịch H2SO4 loãng vào ống nghiệm chứa CaCO3.
b) Dẫn khí H2S vào dung dịch AgNO3.
Câu 4 (1,5 điểm). Bằng phương pháp hoá học, hãy phân biệt 4 dung dịch không màu sau:
KNO3, Na2SO3, K2S, Na2SO4
Câu 5 (1,5 điểm). Xác định các yếu tố ảnh hưởng đến tốc độ phản ứng trong các trường hợp
sau:
a) Ngọn lửa axetilen cháy trong oxi cao hơn nhiều so với cháy trong không khí.
b) Nấu thực phẩm trong nồi áp suất nhanh chín hơn.
c) Để làm mềm thịt, người ta thường cho thêm một ít nước thơm ép ướp cùng thịt
trước khi kho.
Câu 6 (2,0 điểm). Hoà tan 12,84 gam hỗn hợp X gồm Al và Cu bằng dung dịch H2SO4 đặc,
nóng, dư. Sau khi các phản ứng xảy ra hoàn toàn thì thu được 7,392 lít khí SO2 (sản
phẩm khử duy nhất ở đktc).
a) Viết các phương trình hoá học xảy ra.
b) Tính % khối lượng từng kim loại trong hỗn hợp X.
Câu 7 (1,0 điểm). Nhà máy Supephotphat và Hoá chất Lâm Thao tiến hành sản xuất axit
sunfuric từ quặng Pirit theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Tính khối lượng dung dịch H2SO4 98% sản xuất được khi dùng 2,4 tấn quặng Pirit
(chứa 20% tạp chất), biết hiệu suất của cả quá trình là 60%.
----------HẾT----------
Cho: H=1; O=16; Al=27; S=32; Fe=56; Cu=64.
Học sinh không được sử dụng tài liệu khi làm bài. Cán bộ coi thi không giải thích gì thêm.
Họ và tên học sinh: .............................................................................................................. Số báo danh: ...................
MÃ ĐỀ: 101

SỞ GIÁO DỤC VÀ ĐÀO TẠO
THÀNH PHỐ HỒ CHÍ MINH
TRƯỜNG THPT BÌNH CHIỂU
ĐỀ KIỂM TRA HỌC KÌ 2
NĂM HỌC 2020 – 2021
Môn: Hóa học 10
Thời gian làm bài : 45 phút
(không kể thời gian phát đề)
ĐỀ CHÍNH THỨC
Câu 1 (2,0 điểm). Hoàn thành chuỗi phản ứng sau (ghi rõ điều kiện nếu có):
(1) (2) (3) (4)
2 2 2 4
S H S K S K SO KOH
Câu 2 (1,0 điểm). Hoàn thành các phương trình phản ứng sau (ghi rõ điều kiện nếu có):
a) C + H2SO4 (đặc)
0
t
CO2 + SO2 + ?
b) Fe(OH)2 + H2SO4 (đặc)
0
t
? + SO2 + ?
Câu 3 (1,0 điểm). Nêu hiện tượng quan sát được và viết phương trình hóa học xảy ra khi:
a) Thả nhẹ viên kẽm vào dung dịch H2SO4 loãng.
b) Dẫn khí SO2 vào dung dịch Ca(OH)2 dư.
Câu 4 (1,5 điểm). Bằng phương pháp hoá học, hãy phân biệt 4 dung dịch không màu sau:
NaCl, K2CO3, Na2SO3, K2SO4
Câu 5 (1,5 điểm). Xác định các yếu tố ảnh hưởng đến tốc độ phản ứng trong các trường hợp
sau:
a) Thực phẩm được bảo quản trong tủ lạnh sẽ giữ được lâu hơn.
b) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong sản xuất
xi măng).
c) Để làm cơm rượu, người ta thường trộn bột men với cơm trước khi tạo hình và ủ
trong hộp.
Câu 6 (2,0 điểm). Hoà tan hoàn toàn 16,47 gam hỗn hợp X gồm Fe và Zn bằng dung dịch
H2SO4 đặc, nóng, dư. Sau khi các phản ứng xảy ra hoàn toàn thì thu được 7,392 lít
khí SO2 (sản phẩm khử duy nhất ở đktc).
a) Viết các phương trình hoá học xảy ra.
b) Tính % khối lượng từng kim loại trong hỗn hợp X.
Câu 7 (1,0 điểm). Nhà máy Supephotphat và Hoá chất Lâm Thao tiến hành sản xuất axit
sunfuric từ quặng Pirit theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Tính khối lượng dung dịch H2SO4 98% sản xuất được khi dùng 3,6 tấn quặng Pirit
(chứa 20% tạp chất), biết hiệu suất của cả quá trình là 60%.
----------HẾT----------
Cho: H=1; O=16; S=32; Fe=56; Zn=65.
Học sinh không được sử dụng tài liệu khi làm bài. Cán bộ coi thi không giải thích gì thêm.
Họ và tên học sinh: .............................................................................................................. Số báo danh: ...................
MÃ ĐỀ: 102
SỞ GIÁO DỤC VÀ ĐÀO TẠO
THÀNH PHỐ HỒ CHÍ MINH
TRƯỜNG THPT BÌNH CHIỂU
ĐÁP ÁN KIỂM TRA CUỐI HỌC KÌ 2
NĂM HỌC 2020 – 2021
Môn: Hóa học 10
MÃ ĐỀ: 101
Câu
(điểm)
Nội dung
Thang
điểm
Hướng dẫn chấm
1 (2đ)
(1) O2 + S
0
t
SO2
(2) SO2 + 2NaOH
Na2SO3 + H2O
(3) Na2SO3 + H2SO4
Na2SO4 + SO2 + H2O
(4) Na2SO4 + Ba(OH)2
BaSO4 + 2NaOH
0,5
0,5
0,5
0,5
Thiếu cân bằng: -
0,25/phương trình.
Thiếu điều kiện: -
0,25/ phương
trình.
2 (1đ)
a) 2P + 5H2SO4 (đặc)
0
t
2H3PO4 + 5SO2 + 2H2O
b) 2FeO + 4H2SO4 (đặc)
0
t
Fe2(SO4)3 + SO2 + 4H2O
0,5
0,5
3 (1đ)
a) CaCO3 + H2SO4 (loãng)
CaSO4 + H2O + CO2.
Sủi bọt khí không mùi.
b) H2S + 2AgNO3
Ag2S + 2HNO3.
Kết tủa đen.
0,25
0,25
0,25
0,25
Sai phương trình:
Không chấm hiện
tượng.
Cân bằng sai: -
0,25/phương trình.
4 (1,5đ)
MT
TT
KNO3
Na2SO3
K2S
Na2SO4
Dd HCl
-
Khí mùi
hắc
Khí mùi
trứng thối
-
Dd BaCl2
-
x
x
Kết tủa
trắng
Na2SO3 + 2HCl
2NaCl + SO2 + H2O.
K2S + 2HCl
2KCl + H2S.
Na2SO4 + BaCl2
BaSO4 + 2NaCl.
0,75
0,25
0,25
0,25
Sai hiện tượng:
Không chấm
phương trình.
Cân bằng sai: -
0,25/phương trình.
5 (1,5đ)
a) Ngọn lửa axetilen cháy trong oxi cao hơn nhiều so với
cháy trong không khí: Nồng độ.
b) Nấu thực phẩm trong nồi áp suất nhanh chín hơn: Áp
suất.
c) Để làm mềm thịt, người ta thường cho thêm một ít nước
thơm ép ướp cùng thịt trước khi kho: Xúc tác.
0,5
0,5
0,5
6 (2đ)
2Al + 6H2SO4 (đặc)
0
t
Al2(SO4)3 + 3SO2 + 6H2O.
x---------------------------------------------------3x/2 (mol)
Cu + 2H2SO4 (đặc)
0
t
CuSO4 + SO2 + 2H2O.
x----------------------------------------------x (mol)
0,5
0,5
Viết sai phương
trình: Không
chấm điểm.
Cân bằng sai: -
0,25
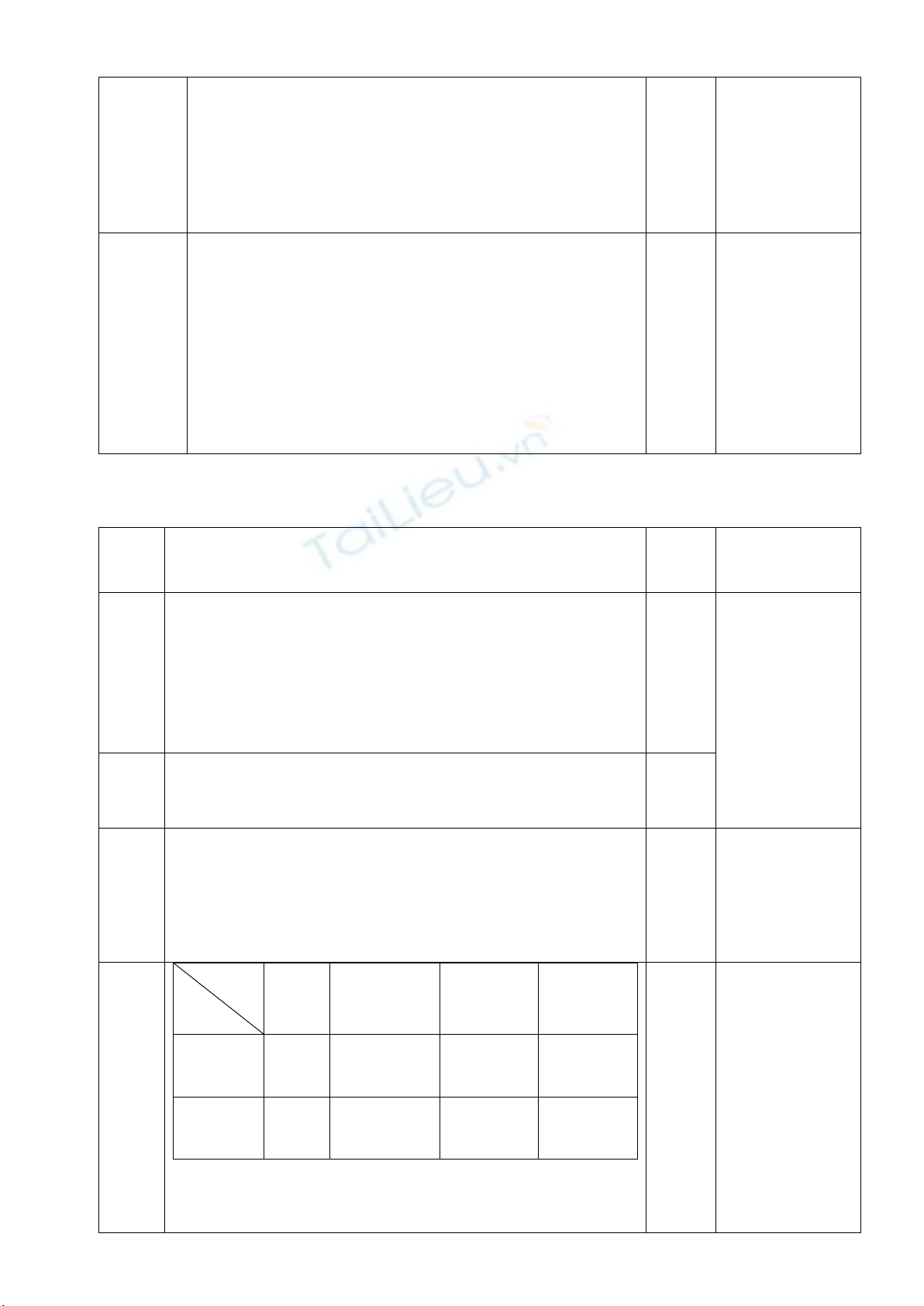
27x+64y=12,84
3x/2 + y = 0,33
x=0,12; y=0,15.
%mAl = 25,23%. (2700/107 %).
%mCu = 74,77%. (8000/107 %)
0,25
0,25
0,25
0,25
7 (1 đ)
Khối lượng FeS2: 2,4.80% = 1,92 (tấn).
FeS2
H=60%
2H2SO4
1 mol--------------1,2 mol
120 gam----------117,6 gam
1,92 tấn-----------1,8816 tấn
Khối lượng dung dịch H2SO4 98% sản xuất được: 1,92
(tấn)
0,25
0,25
0,25
0,25
Ghi chú: HS làm khác đáp án, đúng, chấm trọn điểm.
MÃ ĐỀ: 102
Câu
(điểm
)
Nội dung
Thang
điểm
Hướng dẫn chấm
1 (2đ)
(1) H2 + S
0
t
H2S
(2) H2S + 2KOH
K2S + 2H2O
(3) K2S + H2SO4
K2SO4 + H2S
(4) K2SO4 + Ba(OH)2
BaSO4 + 2KOH
0,5
0,5
0,5
0,5
Thiếu cân bằng: -
0,25/phương trình.
Thiếu điều kiện: -
0,25/ phương
trình.
2 (1đ)
a) C + 2H2SO4 (đặc)
0
t
CO2 + 2SO2 + 2H2O
b) 2Fe(OH)2+4H2SO4 (đặc)
0
t
Fe2(SO4)3 + SO2 + 6H2O
0,5
0,5
3 (1đ)
a) Zn + H2SO4 (loãng)
ZnSO4 + H2.
Sủi bọt khí không mùi.
b) SO2 + Ca(OH)2 (dư)
CaSO3 + H2O.
Kết tủa trắng.
0,25
0,25
0,25
0,25
Sai phương trình:
Không chấm hiện
tượng.
Cân bằng sai: -
0,25/phương trình.
4
(1,5đ)
MT
TT
NaCl
K2CO3
Na2SO3
K2SO4
Dd HCl
-
Khí không
mùi
Khí mùi
hắc
-
Dd BaCl2
-
x
x
Kết tủa
trắng
Na2SO3 + 2HCl
2NaCl + SO2 + H2O.
K2CO3 + 2HCl
2KCl + CO2 + H2O.
0,75
0,25
0,25
Sai hiện tượng:
Không chấm
phương trình.
Cân bằng sai: -
0,25/phương trình.
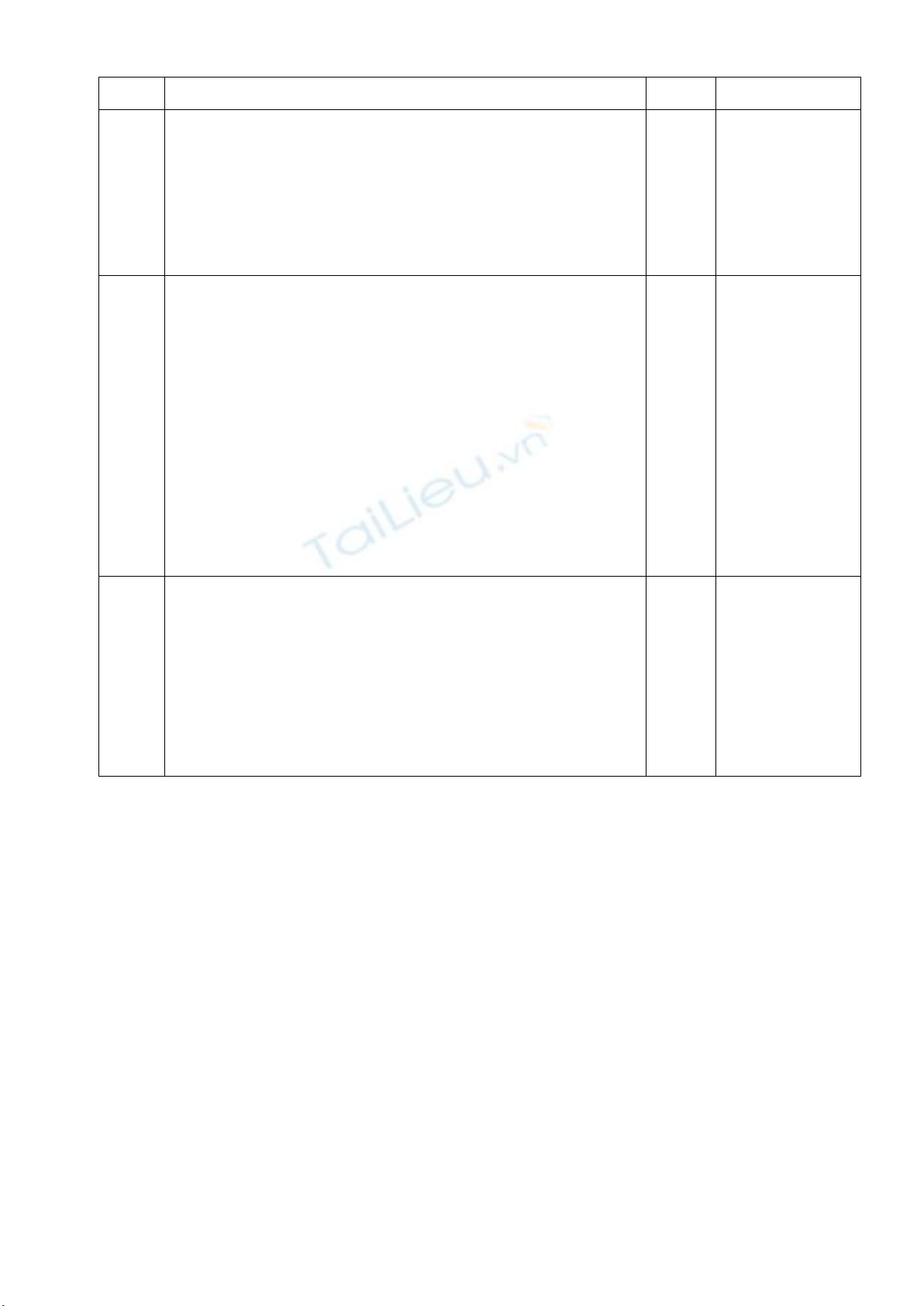
K2SO4 + BaCl2
BaSO4 + 2KCl.
0,25
5
(1,5đ)
a) Thực phẩm được bảo quản trong tủ lạnh sẽ giữ được lâu
hơn: Nhiệt độ.
b) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất
clanhke (trong sản xuất xi măng): Diện tích tiếp xúc.
c) Để làm cơm rượu, người ta thường trộn bột men với cơm
trước khi tạo hình và ủ trong hộp: Xúc tác.
0,5
0,5
0,5
6 (2đ)
2Fe + 6H2SO4 (đặc)
0
t
Fe2(SO4)3 + 3SO2 + 6H2O.
x---------------------------------------------------3x/2 (mol)
Zn + 2H2SO4 (đặc)
0
t
ZnSO4 + SO2 + 2H2O.
x----------------------------------------------x (mol)
56x+65y=16,47
3x/2 + y = 0,33
x=0,12; y=0,15.
%mAl = 40,80%. (22400/549 %).
%mCu = 59,20%. (32500/549 %)
0,5
0,5
0,25
0,25
0,25
0,25
Viết sai phương
trình: Không
chấm điểm.
Cân bằng sai: -
0,25
7 (1 đ)
Khối lượng FeS2: 3,6.80% = 2,88 (tấn).
FeS2
H=60%
2H2SO4
1 mol--------------1,2 mol
120 gam----------117,6 gam
2,88 tấn-----------2,8224 tấn
Khối lượng dung dịch H2SO4 98% sản xuất được: 2,88 (tấn)
0,25
0,25
0,25
0,25
Ghi chú: HS làm khác đáp án, đúng, chấm trọn điểm.












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



