Trang 1/2 - Mã đề thi 001
TRƯỜNG THPT
LƯƠNG NGỌC QUYẾN
BÀI KIỂM TRA HỌC KÌ II – NĂM HỌC 2020 - 2021
Môn: Hóa học- Lớp 10
Thời gian làm bài : 45 phút
Họ và tên học sinh:…………..…..............…Lớp:……… SBD: …….... Phòng: ………
Mã đề 001
Cho NTK: Mg = 24, Ca = 40, Ba = 137, Cu = 64O = 16, S = 32, C = 12, N = 14,Na = 23, K = 39,
F = 9, Cl = 35,5 , Br = 80, I = 127, Fe = 56, Mn = 55, Cr= 52, Ag = 108, Al = 27, Zn = 65.
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN ( 7điểm)
( Học sinh tô vào phiếu trả lời trắc nghiệm)
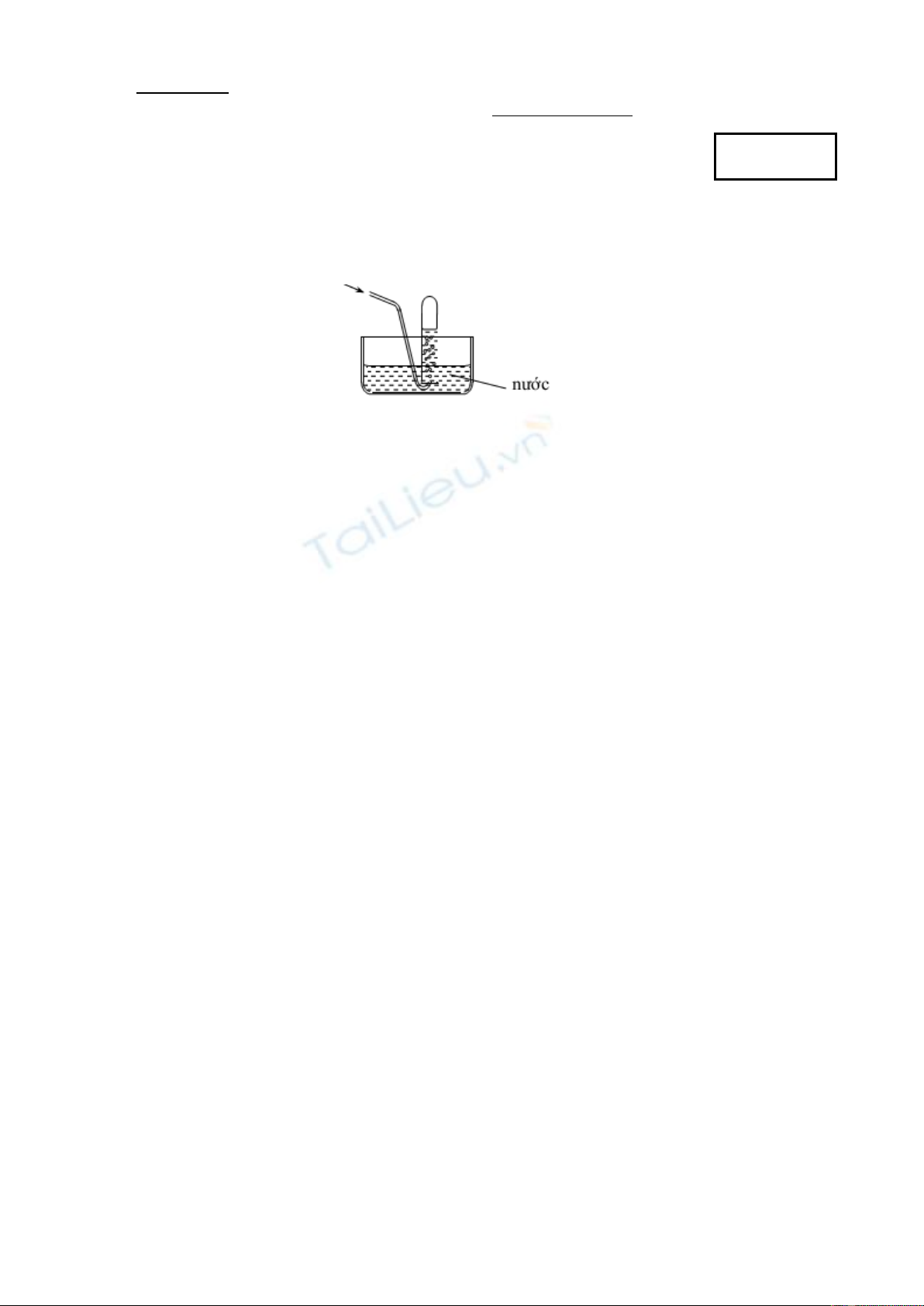
Câu 1: Cho phương pháp thu khí sau:
Có thể áp dụng để thu khí nào sau đây?
A. O2. B. Cl2. C. HCl D. SO2.
Câu 2: Để nhận biết ion clorua trong dung dịch, người ta dùng hóa chất nào sau đây:
A. BaCl2. B. H2SO4. C. Quỳ tím. D. AgNO3.
Câu 3: Hoà tan hoàn toàn 5,6 gam Fe cần vừa đủ dung dịch chứa x mol H2SO4 loãng. Giá trị của x là
A. 0,20. B. 0,15. C. 0,05 . D. 0,10.
Câu 4: Ứng dụng nào sau đây không phải của ozon?
A. Chữa sâu răng. B. Tẩy trắng tinh bột, dầu ăn.
C. Điều chế oxi trong phòng thí nghiệm. D. Sát trùng nước sinh hoạt
Câu 5: Muốn pha loãng H2SO4 đặc, phải rót
A. nhanh nước vào axit và khuấy nhẹ. B. từ từ nước vào axit và khuấy nhẹ.
C. nhanh axit vào nước và khuấy nhẹ. D. từ từ axit vào nước và khuấy nhẹ.
Câu 6: Lưu huỳnh đioxit có công thức là
A. H2S. B. SO3. C. SO2. D. H2SO4.
Câu 7: Công thức của muối Nhôm sunfat?
A. Al2(SO4)3. B. AlCl3. C. Al(NO3)3. D. AlBr3.
Câu 8: Vị trí của nguyên tố Oxi trong bảng tuần hoàn hoàn hóa học là
A. Ô thứ 8, chu kì 3, nhóm VI B. Ô thứ 8, chu kì 2, nhóm VI A.
C. Ô thứ 16, chu kì 3, nhóm VI A. D. Ô thứ 16, chu kì 2, nhóm VI A.
Câu 9: Hấp thụ hết 0,1 mol SO2 vào dung dịch NaOH dư, thu được muối trung hòa. Số mol NaOH đã phản
ứng là
A. 0,10. B. 0,20. C. 0,15. D. 0,05.
Câu 10: Axit nào sau đây có đặc tính ăn mòn các đồ vật bằng thủy tinh:
A. H2SO4 B. HI C. HCl D. HF
Câu 11: Ở điều kiện thường, hiđro sunfua là chất
A. khí, không mùi. B. khí, mùi trứng thối.
C. lỏng, không màu. D. lỏng, mùi trứng thối.
Câu 12: SO2 vừa có tính oxi hoá, vừa có tính khử vì trong phân tử SO2
A. S có mức oxi hoá thấp nhất. B. S còn có một đôi electron tự do.
C. S có mức oxi hoá cao nhất. D. S có mức oxi hoá trung gian.
Câu 13: Ở điều kiện thường, clo là chất
A. khí màu vàng lục. B. rắn màu lục nhạt. C. rắn màu vàng. D. khí không màu.

Trang 2/2 - Mã đề thi 001
Câu 14: Trong bảng tuần hoàn, lưu huỳnh thuộc nhóm VIA. Số electron lớp ngoài cùng của nguyên tử lưu
huỳnh là A. 4. B. 5. C. 6. D. 7.
Câu 15: Công thức của muối natri clorua là
A. NaClO. B. CaOCl2. C. KCl. D. NaCl.
Câu 16: Sục khí ozon vào dung dịch KI xảy ra phản ứng : O3 + 2KI + H2O → I2 + 2 KOH + O2 .Vai Trò của
O3 trong phản ứng này là
A. Vừa oxi hóa ,vừa khử. B. Môi trường. C. Chất Oxi hóa. D. Chất khử.
Câu 17: Trong y học đơn chất halogen nào hòa tan trong rượu etylic được dùng làm chất sát trùng?
A. I2. B. F2. C. Cl2. D. Br2
Câu 18: Hấp thụ SO3 bằng H2SO4 đặc (98%), thu được oleum có công thức dạng
A. H2SO4.nH2O. B. H2SO4.nSO3. C. H2SO4.nSO2. D. H2SO4.
Câu 19: Đơn chất vừa có tính oxi hóa, vừa có tính khử là
A. S. B. O3. C. F2. D. O2.
Câu 20: Cho phản ứng X2 + 2NaI → 2NaX + I2. Cặp chất nào thỏa mãn sơ đồ trên?
A. Br2, I2. B. F2, I2. C. Cl2, Br2. D. F2, Cl2.
Câu 21: Nhóm kim loại nào sau đây không phản ứng với H2SO4.loãng?
A. Al, Fe. B. Cu, Ag. C. Ca, Zn. D. Mg, Fe.
Câu 22: Khí nào sau đây có trong không khí đã làm cho các đồ dùng bằng bạc lâu ngày bị xám đen?
A. H2S. B. SO2. C. CO2. D. O2.
Câu 23: Khi dẫn khí SO2 vào dung dịch H2S thì trong dung dịch xuất hiện
A. kết tủa màu đen. B. kết tủa màu trắng.
C. kết tủa màu vàng. D. kết tủa màu đỏ.
Câu 24: Chất nào sau đây nhận biết được ion sunfat
2-
4
SO
?
A. KNO3. B. BaCl2. C. HCl. D. HNO3.
Câu 25: Nguyên tử Flo có cấu hình electron lớp ngoài cùng là
A. 2s22p5. B. 3s23p5. C. 5s25p5. D. 4s24p5.
Câu 26: Số nguyên tử oxi trong phân tử lưu huỳnh trioxit là
A. 4. B. 1. C. 3. D. 2.
Câu 27: Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng và dung dịch H2SO4 đặc nóng cho 2
loại muối khác nhau?
A. Cu. B. Fe. C. Mg . D. Ag.
Câu 28: Dẫn khí X vào nước brom, thấy nước brom mất màu. Khí X là
A. CO2. B. N2. C. O2. D. SO2.
--- II. PHẦN TỰ LUẬN ( 3 điểm)
-------------------------------------------
Câu 29: (1,0 điểm) Hoàn thành các phương trình hoá học sau(ghi rừ điều kiện nếu có):
S
(1)
SO2
(2)
SO3
(3)
H2SO4
(4)
K2SO4
Câu 30: (1,0 điểm) Tỉ khối hơi của hỗn hợp gồm ozon và oxi đối với hidro là 22,4. Xác định % về thể tích của
mỗi khí trong hỗn hợp.
Câu 31 : (0,5 điểm) Khi làm thí nghiệm điều chế các khí H2S và khí Cl2. Một học sinh đề xuất dùng H2SO4 đặc
để làm khô hai khí này. Hãy cho biết quan điểm của em về đề xuất trên. Giải thích và viết phương trình phản
ứng (nếu có).
Câu 32 : (0,5 điểm) Hòa tan hoàn toàn 11,9 gam Al, Zn vào dung dịch H2SO4 đặc, nóng thu được dung dich X;
7,616 lít khí SO2 (đktc) và 0,64 gam S. Tính khối lượng muối trong X ?
......................Hết....................................
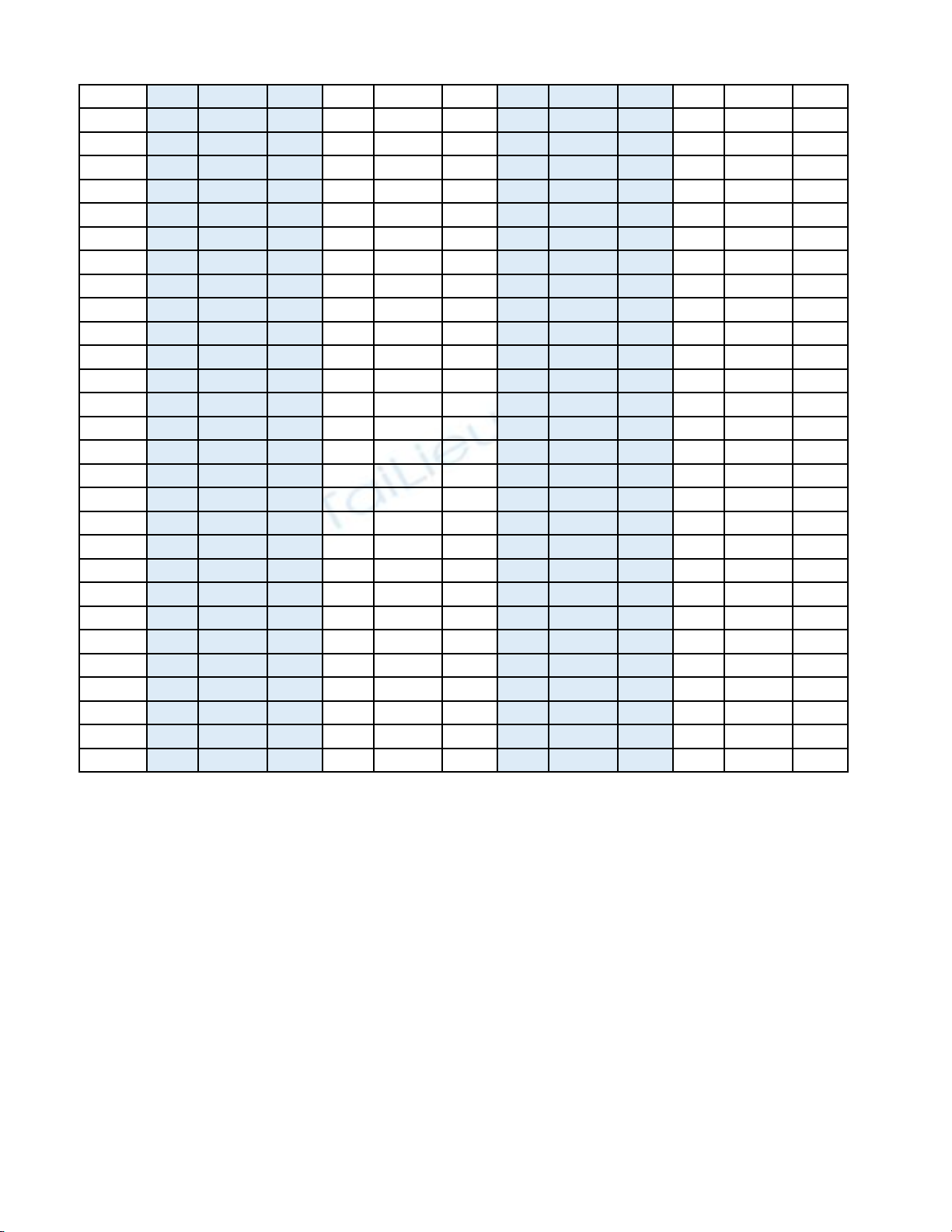
mamon made cautron dapan made cautron dapan made cautron dapan made cautron dapan
ĐỀ 1 001 1 A 003 1 B 005 1 B 007 1 A
ĐỀ 1 001 2 D 003 2 D 005 2 D 007 2 A
ĐỀ 1 001 3 D 003 3 D 005 3 A 007 3 B
ĐỀ 1 001 4 C 003 4 D 005 4 A 007 4 B
ĐỀ 1 001 5 D 003 5 A 005 5 B 007 5 B
ĐỀ 1 001 6 C 003 6 C 005 6 C 007 6 C
ĐỀ 1 001 7 A 003 7 C 005 7 B 007 7 B
ĐỀ 1 001 8 B 003 8 C 005 8 C 007 8 D
ĐỀ 1 001 9 B 003 9 A 005 9 C 007 9 D
ĐỀ 1 001 10 D 003 10 A 005 10 C 007 10 C
ĐỀ 1 001 11 B 003 11 A 005 11 B 007 11 B
ĐỀ 1 001 12 D 003 12 B 005 12 D 007 12 D
ĐỀ 1 001 13 A 003 13 B 005 13 B 007 13 A
ĐỀ 1 001 14 C 003 14 A 005 14 A 007 14 D
ĐỀ 1 001 15 D 003 15 D 005 15 D 007 15 D
ĐỀ 1 001 16 C 003 16 D 005 16 B 007 16 C
ĐỀ 1 001 17 A 003 17 C 005 17 C 007 17 C
ĐỀ 1 001 18 B 003 18 A 005 18 C 007 18 D
ĐỀ 1 001 19 A 003 19 C 005 19 B 007 19 A
ĐỀ 1 001 20 C 003 20 D 005 20 D 007 20 B
ĐỀ 1 001 21 B 003 21 A 005 21 A 007 21 C
ĐỀ 1 001 22 A 003 22 C 005 22 A 007 22 A
ĐỀ 1 001 23 C 003 23 B 005 23 D 007 23 C
ĐỀ 1 001 24 B 003 24 D 005 24 D 007 24 D
ĐỀ 1 001 25 A 003 25 B 005 25 D 007 25 A
ĐỀ 1 001 26 C 003 26 B 005 26 C 007 26 A
ĐỀ 1 001 27 B 003 27 C 005 27 A 007 27 B
ĐỀ 1 001 28 D 003 28 B 005 28 A 007 28 C
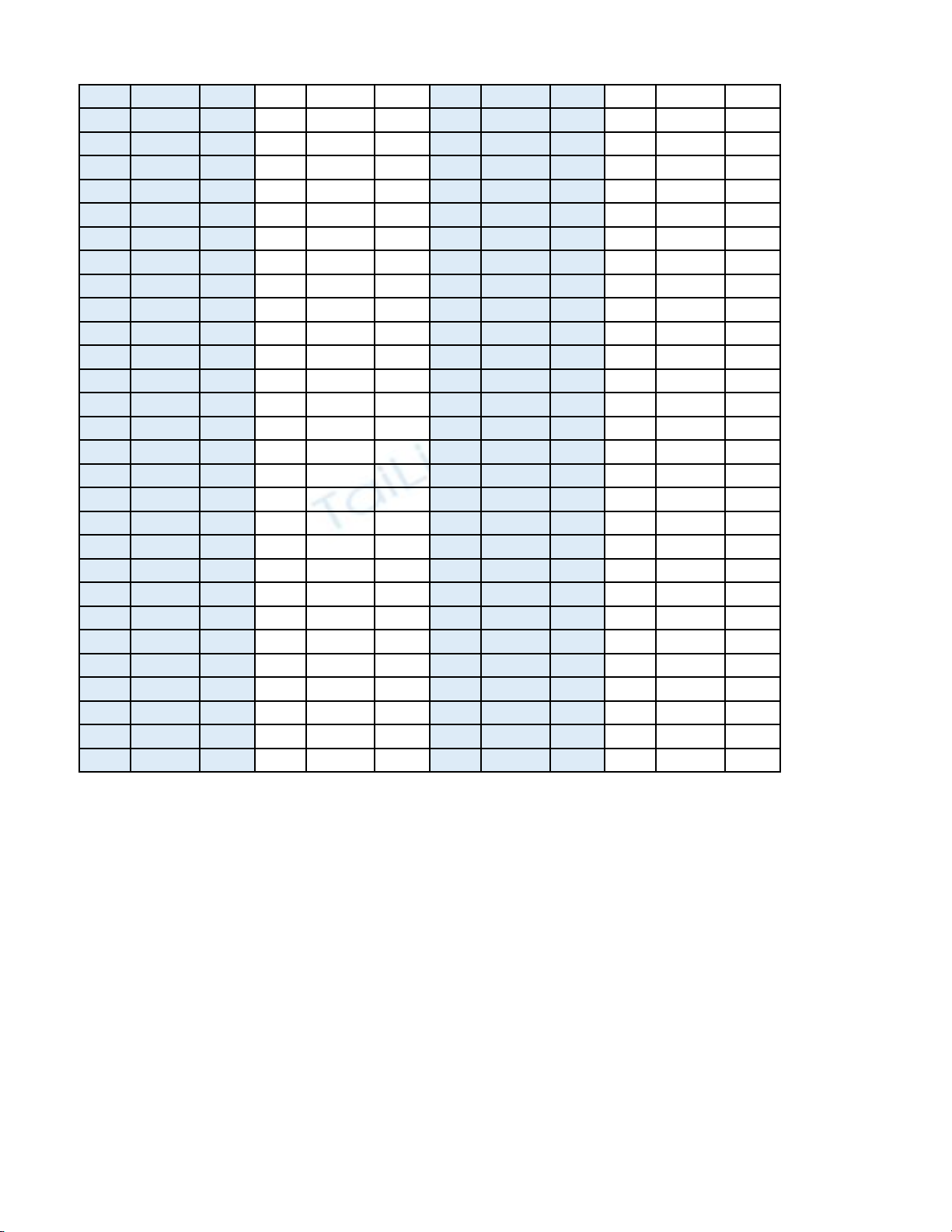
made cautron dapan made cautron dapan made cautron dapan made cautron dapan
009 1 A 011 1 D 013 1 C 015 1 A
009 2 B 011 2 C 013 2 C 015 2 D
009 3 A 011 3 B 013 3 C 015 3 D
009 4 C 011 4 A 013 4 B 015 4 B
009 5 D 011 5 C 013 5 A 015 5 C
009 6 D 011 6 A 013 6 A 015 6 D
009 7 B 011 7 D 013 7 D 015 7 A
009 8 C 011 8 C 013 8 A 015 8 A
009 9 A 011 9 B 013 9 A 015 9 B
009 10 C 011 10 B 013 10 A 015 10 A
009 11 A 011 11 B 013 11 D 015 11 C
009 12 A 011 12 D 013 12 D 015 12 B
009 13 D 011 13 A 013 13 A 015 13 A
009 14 B 011 14 D 013 14 C 015 14 D
009 15 B 011 15 C 013 15 B 015 15 D
009 16 C 011 16 B 013 16 C 015 16 A
009 17 B 011 17 A 013 17 B 015 17 A
009 18 A 011 18 C 013 18 C 015 18 C
009 19 B 011 19 B 013 19 D 015 19 B
009 20 D 011 20 C 013 20 D 015 20 D
009 21 D 011 21 D 013 21 B 015 21 B
009 22 C 011 22 A 013 22 A 015 22 C
009 23 B 011 23 A 013 23 D 015 23 D
009 24 A 011 24 D 013 24 D 015 24 C
009 25 D 011 25 C 013 25 B 015 25 B
009 26 C 011 26 B 013 26 B 015 26 C
009 27 D 011 27 A 013 27 C 015 27 B
009 28 C 011 28 D 013 28 B 015 28 C
ĐÁP ÁN TỰ LUẬN KÌ II HÓA 10- 2021
NỘI DUNG
Điể
m
Câu 1
1,0 Điểm
- 4 PT mỗi PT 0,25 điểm
Câu 2
Mã ( 001;003;005;007;009;011;013;015)
Tỉ khối hơi của hỗn hợp gồm ozon và oxi đối với hidro là 22,4. Xác định % về thể tích
của mỗi khí trong hỗn hợp.
Áp dụng phương pháp đường chéo, ta có:
)23(MO2
3,2 1 20%
)84(MO3
12,8 4 80%
Mã ( 002;004;006;008;010;012;014;016)
Có mt hỗn hợp kh gồm oxi và ozon. Hỗn hợp kh này có tỉ khối đối với kh hidro bng
18. Xác định % ( theo thể tch) mỗi kh trong hỗn hợp.
Áp dụng phương pháp đường chéo, ta có:
)23(MO2
12 3 75%
)84(MO3
4 1 25%
Câu 3
Đề 001,003,005,007,009,011, 013,015
Dùng H2SO4 đặc:
- Làm khô được Cl2 vì Cl2 không phản ứng với H2SO4 đặc.
- Không làm khô được H2S, vì H2S phản ứng được với H2SO4 đặc.
2 2 4 2
3H S + H SO 4S + 4H O
Hoặc
2 2 4 2 2
H S + 3H SO 4SO + 4H O
Đề 002,004,006,008,010,012, 014,016
Dùng H2SO4 đặc:
- Làm khô được O2 vì O2 không phản ứng với H2SO4 đặc.
- Không làm khô được H2S, vì H2S phản ứng được với H2SO4 đặc.
2 2 4 2
3H S + H SO 4S + 4H O
Hoặc
2 2 4 2 2
H S + 3H SO 4SO + 4H O
Câu 4
Đề 001,003,005,007,009,011, 013,015
nSO2 = 0,34 mol; nS= 0,02 mol
Đặt số mol Al, Zn lần lượt là x và y ta có:
Al → Al 3+ +3e
x 3x
22,4.2=44, 8
18.2=36












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



