
Trang 1/2 - Mã đề 301
SỞ GD & ĐT QUẢNG NAM
TRƯỜNG THPT LƯƠNG THẾ VINH
ĐỀ KIỂM TRA CUỐI HỌC KỲ II – NH 2020-2021
Môn: HOÁ HỌC – Lớp 10
Thời gian: 45 phút (không kể thời gian giao đề)
(Đề gồm có 2 trang)
Mã đề 301
Họ, tên học sinh:................................................................. Số báo danh:.....................
Cho nguyên tử khối: H = 1; C = 12; O = 16; S = 32;Cl= 35,5; Mg =24; K = 39;
Mn = 55; Ba = 137;
I. TRẮC NGHIỆM: (7,0 điểm)
Câu 1: Clorua vôi có công thức là
A. CaCl2. B. CaOCl. C. CaOCl2. D. Ca(OCl)2.
Câu 2: Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch
H2SO4 đặc, nguội?
A. Al, Fe, Cr. B. Pt, Au, Mg. C. Al, Fe, Mg. D. Al, Fe, Zn.
Câu 3: Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây?
A. FeCl3, MgO, Cu. B. Al, Fe(OH)3, BaCl2. C. NaOH, CuO, Ag. D. Mg(OH)2, Cu, SO2.
Câu 4: Trong công nghiệp, người ta điều chế oxi bằng cách nào?
A. Nhiệt phân Cu(NO3)2. B. Nhiệt phân KMnO4.
C. Nhiệt phân KClO3 có xúc tác MnO2. D. Chưng cất phân đoạn không khí lỏng.
Câu 5: Để pha loãng axit sunfuric đặc, an toàn nên
A. cho đồng thời axit và nước vào cốc và dùng đũa thuỷ tinh khuấy đều.
B. cho nhanh axit vào nước và dùng đũa thuỷ tinh khuấy đều.
C. cho từ từ nước vào axit và dùng đũa thuỷ tinh khuấy đều.
D. cho từ từ axit vào nước và dùng đũa thuỷ tinh khuấy đều.
Câu 6: Chúng ta đều biết hơi thủy ngân rất độc, vậy trong trường hợp ta làm vỡ nhiệt kế thủy ngân,
chúng ta dùng chất gì rắc lên thủy ngân và gom lại?
A. Bột than. B. Lưu huỳnh. C. Muối hạt. D. Cát mịn.
Câu 7: Tìm câu sai khi nhận xét về H2S
A. Là khí không màu, mùi trứng thối, nặng hơn không khí. B. Tan ít trong nước.
C. Làm xanh quỳ tím ẩm. D. Chất rất độc.
Câu 8: Để nhận biết iot, ta dùng
A. dung dịch AgNO3. B. dung dịch HCl. C. quỳ tím. D. hồ tinh bột.
Câu 9: Kim loại nào sau đây tác dụng với dung dịch HCl và tác dụng với khí clo cho cùng loại
muối?
A. Zn. B. Fe. C. Ag. D. Cu.
Câu 10: Oxi không phản ứng trực tiếp với
A. Cacbon. B. Natri. C. Flo. D. Lưu huỳnh.
Câu 11: Trong phòng thí nghiệm, khí Clo được điều chế bằng cách cho axit clohidric đặc tác dụng
với
A. MnO2. B. MnCl2. C. NaCl. D. NaOH.
Câu 12: Cho phản ứng: Cl2 + H2O
HCl + HClO, phát biểu nào sau đây đúng?
A. Nước đóng vai trò chất khử.
B. Clo vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
C. Clo chỉ đóng vai trò chất khử.
D. Clo chỉ đóng vai trò chất oxi hoá.
Câu 13: Trường hợp nào không xảy ra phản ứng hóa học?
A. Cl2 + NaBr. B. Br2 + KI. C. Cl2 + KI. D. I2 + NaBr.

Trang 2/2 - Mã đề 301
Câu 14: Phản ứng nào thể hiện tính oxi hoá của khí SO2?
A. SO2 + H2O → H2SO3. B. SO2 + Ba(OH)2 → BaSO3 + H2O.
C. SO2 + 2H2S → 3S + 2H2O. D. SO2 + Cl2 + 2H2O → H2SO4 + 2HCl.
Câu 15: Ứng dụng nào sau đây không phải của lưu huỳnh?
A. Làm nguyên liệu sản xuất H2SO4. B. Làm chất lưu hóa cao su.
C. Khử chua đất. D. Điều chế thuốc súng đen.
Câu 16: Cấu hình electron của nguyên tử lưu huỳnh (Z =16) là
A. 1s22s22p63s23p6. B. 1s22s22p63s23p4. C. 1s22s22p63s23p2. D. 1s22s22p63s23p3.
Câu 17: Lưu huỳnh thể hiện tính khử khi tác dụng với chất nào sau đây?
A. S + O2
o
t
SO2. B. 3S + 2Al
o
t
Al2S3.
C. S + Hg HgS. D. S + H2
o
t
H2S.
Câu 18: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố halogen là
A. ns2np5. B. ns2np6. C. ns2np3. D. ns2np4.
Câu 19: Ở điều kiện thường, flo tồn tại ở trạng thái
A. lỏng. B. khí. C. plasma. D. rắn.
Câu 20: Hiđro sunfua có tính chất hóa học đặc trưng là
A. vừa có tính oxi hóa, vừa có tính khử. B. tính oxi hóa.
C. không có tính oxi hóa, không có tính khử. D. tính khử.
Câu 21: Cho 31,6 gam KMnO4 tác dụng với axit HCl đặc, dư thu được V lít khí Cl2 (đktc). Giá trị
của V là
A. 4,48. B. 6,72. C. 11,2. D. 22,4.
II. TỰ LUẬN: (3,0 điểm)
Câu 1 (2,0 điểm).
a. (1,0 điểm). Khi cho m gam kim loại Mg phản ứng hoàn toàn với dung dịch H2SO4 đặc, nóng, dư
thì thu được 3,36 lít khí SO2 (đktc) (sản phẩm khử duy nhất).
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính khối lượng m gam Mg đã tham gia phản ứng.
b. (1,0 điểm). Cho 8,32 gam BaCl2 tác dụng hết với V lít dung dịch K2SO4 0,1M.
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính V lít dung dịch K2SO4 0,1M đã dùng.
Câu 2. (1,0 điểm).
a. (0,5 điểm). Nhận biết các dung dịch mất nhãn đựng trong các lọ riêng biệt sau:
HCl, Na2SO4, KNO3.
b. (0,5 điểm). Hỗn hợp khí A gồm có O2 và O3, tỉ khối hơi của hỗn hợp khí A đối với hiđro là 19,2.
Hỗn hợp khí B gồm có H2 và CO, tỉ khối hơi của hỗn hợp khí B đối với hiđro là 3,6.
Tính số mol hỗn hợp khí A cần để đốt cháy hết 5 mol hỗn hợp khí B ở cùng điều kiện nhiệt độ
và áp suất.
------ HẾT ------
Học sinh được sử dụng Bảng tuần hoàn các nguyên tố hóa học.
SỞ GDĐT TỈNH QUẢNG NAM
TRƯỜNG THPT LƯƠNG THẾ VINH
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM
ĐỀ KIỂM TRA CUỐI HỌC KỲ II – NĂM HỌC 2020-2021
MÔN: HÓA HỌC – LỚP 10
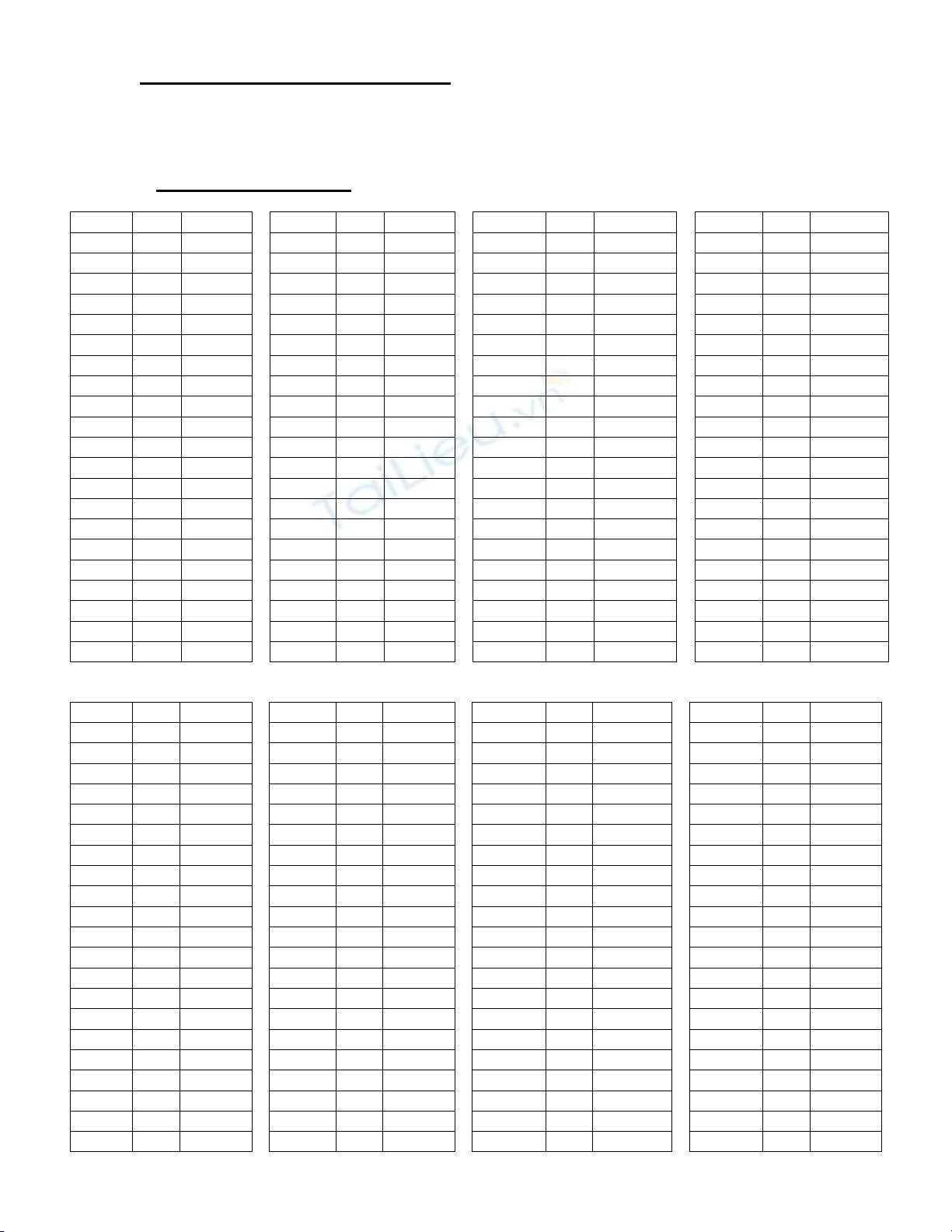
I. PHẦN TRẮC NGHIỆM
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
301
1
C
302
1
D
303
1
C
304
1
C
301
2
A
302
2
C
303
2
A
304
2
A
301
3
B
302
3
A
303
3
B
304
3
A
301
4
D
302
4
B
303
4
C
304
4
B
301
5
D
302
5
A
303
5
B
304
5
C
301
6
B
302
6
B
303
6
D
304
6
A
301
7
C
302
7
D
303
7
A
304
7
D
301
8
D
302
8
C
303
8
B
304
8
C
301
9
A
302
9
D
303
9
B
304
9
B
301
10
C
302
10
A
303
10
D
304
10
D
301
11
A
302
11
C
303
11
C
304
11
A
301
12
B
302
12
D
303
12
B
304
12
B
301
13
D
302
13
B
303
13
D
304
13
C
301
14
C
302
14
A
303
14
B
304
14
D
301
15
C
302
15
B
303
15
A
304
15
C
301
16
B
302
16
B
303
16
A
304
16
D
301
17
A
302
17
A
303
17
C
304
17
B
301
18
A
302
18
C
303
18
C
304
18
A
301
19
B
302
19
C
303
19
A
304
19
B
301
20
D
302
20
D
303
20
D
304
20
C
301
21
C
302
21
A
303
21
D
304
21
D
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
Mã đề
Câu
Đáp án
305
1
B
306
1
D
307
1
D
308
1
C
305
2
A
306
2
A
307
2
A
308
2
B
305
3
C
306
3
C
307
3
A
308
3
D
305
4
C
306
4
D
307
4
C
308
4
D
305
5
A
306
5
B
307
5
B
308
5
A
305
6
D
306
6
B
307
6
D
308
6
A
305
7
A
306
7
D
307
7
A
308
7
C
305
8
C
306
8
A
307
8
D
308
8
A
305
9
B
306
9
D
307
9
D
308
9
D
305
10
D
306
10
A
307
10
B
308
10
A
305
11
D
306
11
B
307
11
C
308
11
C
305
12
A
306
12
B
307
12
B
308
12
A
305
13
B
306
13
B
307
13
A
308
13
B
305
14
B
306
14
A
307
14
A
308
14
B
305
15
D
306
15
C
307
15
B
308
15
B
305
16
D
306
16
B
307
16
D
308
16
C
305
17
C
306
17
D
307
17
C
308
17
C
305
18
B
306
18
C
307
18
C
308
18
C
305
19
C
306
19
C
307
19
C
308
19
D
305
20
B
306
20
A
307
20
B
308
20
D
305
21
A
306
21
C
307
21
D
308
21
B

II. PHẦN TỰ LUẬN MÃ ĐỀ 301, 303, 305, 307
Nội dung
Điểm
Câu 1 (2,0 điểm).
a. (1,0 điểm). Khi cho m gam kim loại Mg phản ứng hoàn toàn với dung dịch H2SO4 đặc,
nóng, dư thì thu được 3,36 lít khí SO2 (đktc) ( sản phẩm khử duy nhất).
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính khối lượng m gam Mg đã tham gia phản ứng.
b. (1,0 điểm). Cho 8,32 gam BaCl2 tác dụng hết với V lít dung dịch K2SO4 0,1 M.
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính V lít dung dịch K2SO4 0,1 M đã dùng.
a. Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O.
Số mol SO2: 0,15 mol.
Số mol Mg: 0,15 mol.
Khối lượng m = 3,6 gam.
(Học sinh không cân bằng vẫn nhận 0,25đ cho phương trình nhưng không cho điểm
phần tính ra m. Học sinh làm cách khác nhưng đúng vẫn đạt điểm tối đa).
0,25
0,25
0,25
0,25
b. Pt: BaCl2 + K2SO4 → BaSO4 + 2KCl.
Số mol BaCl2: 0,04 mol
Số mol K2SO4 phản ứng: 0,04 mol.
Giá trị của V: 0,04/0,1= 0,4 lít.
0,25
0,25
0,25
0,25
Câu 2. (1,0 điểm).
a.(0,5 điểm). Nhận biết các dung dịch mất nhãn đựng trong các lọ riêng biệt sau:
HCl, KCl, Na2SO4, KNO3.
b. (0,5 điểm). Hỗn hợp khí A gồm có O2 và O3, tỉ khối hơi của hỗn hợp khí A đối với
hiđro là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối hơi của hỗn hợp khí B đối với
hiđro là 3,6.
Tính số mol hỗn hợp khí A cần để đốt cháy hết 5 mol hỗn hợp khí B ở cùng điều kiện
nhiệt độ và áp suất.
a.Nhận biết ra mỗi chất và viết ptpứ đúng thì cho 0,25; đúng cả 3 chất và viết ptpứ đúng
hết mới cho điểm tối đa.
0,5
b. PTKTB của hỗn hợp A = 19,2 . 2 = 38,4
PTKTB của hỗn hợp B = 3,6 . 2 = 7,2
Dùng qui tắc đường chéo tính được tỉ lệ mol của O2/O3 = 3/2
Dùng qui tắc đường chéo tính được tỉ lệ mol của H2/CO = 4/1
Qui đổi hỗn hợp A thành O2. Giả sử ta có 1 mol A = 0,6 mol O2 và 0,4 mol O3
Mà : 2O3 3O2
0,4mol 0,6mol
Vậy trong 1 mol A có 1,2 mol O2
Vì tỉ lệ mol của H2/CO = 4/1
Nên trong 5 mol hỗn hợp B có 4 mol H2 và 1 mol CO
PTPỨ cháy: 2H2 + O2 2H2O 2CO + O2 2CO2
4mol 2mol 1mol 0,5mol
Suy ra tổng số mol O2 phản ứng = 2,5 mol.
Suy ra số mol hỗn hợp A cần = 2,5.1/1,2 = 2,083 mol.
(Học sinh làm cách khác nhưng đúng vẫn đạt điểm tối đa)
0,5
0,25
0,25

MÃ ĐỀ 302, 304, 306, 308
Nội dung
Điểm
II. TỰ LUẬN: (3,0 điểm)
Câu 1 (2,0 điểm).
a.(1,0 điểm).Khi cho m gam kim loại Zn phản ứng hoàn toàn với dung dịch H2SO4
đặc, nóng, dư thì thu được 5,6 lít khí SO2 (đktc) ( sản phẩm khử duy nhất).
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính khối lượng m gam Zn đã tham gia phản ứng.
b. (1,0 điểm). Cho 10,4 gam BaCl2 tác dụng hết với V lít dung dịch Na2SO4 0,2 M.
- Viết phương trình hóa học của phản ứng xảy ra.
- Tính V lít dung dịch Na2SO4 0,2 M đã dùng.
a. Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O.
Số mol SO2: 0,25 mol.
Số mol Zn: 0,25 mol.
Khối lượng m = 16,25 gam.
(Học sinh không cân bằng vẫn nhận 0,25đ cho phương trình nhưng không cho điểm phần
tính ra m. Học sinh làm cách khác nhưng đúng vẫn đạt điểm tối đa).
0,25
0,25
0,25
0,25
b.Pt: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Số mol BaCl2: 0,05 mol
Số mol Na2SO4 phản ứng: 0,05 mol.
Giá trị của V: 0,05/0,2= 0,25 lít.
0,25
0,25
0,25
0,25
Câu 2. (1,0 điểm).
a.(0,5 điểm). Nhận biết các dung dịch mất nhãn đựng trong các lọ riêng biệt sau:
H2SO4, K2SO4, NaCl, Ca(NO3)2.
b.(0,5 điểm). Hỗn hợp khí A gồm có O2 và O3, tỉ khối hơi của hỗn hợp khí A đối với hiđro
là 19,2. Hỗn hợp khí B gồm có H2 và CO, tỉ khối hơi của hỗn hợp khí B đối với hiđro là
3,6.
Tính số mol hỗn hợp khí A cần để đốt cháy hết 5 mol hỗn hợp khí B ở cùng điều kiện
nhiệt độ và áp suất.
a.Nhận biết ra mỗi chất và viết ptpứ đúng thì cho 0,25; đúng cả 3 chất và viết ptpứ đúng
hết mới cho điểm tối đa.
0,5
b. PTKTB của hỗn hợp A = 19,2 . 2 = 38,4
PTKTB của hỗn hợp B = 3,6 . 2 = 7,2
Dùng qui tắc đường chéo tính được tỉ lệ mol của O2/O3 = 3/2
Dùng qui tắc đường chéo tính được tỉ lệ mol của H2/CO = 4/1
Qui đổi hỗn hợp A thành O2. Giả sử ta có 1 mol A = 0,6 mol O2 và 0,4 mol O3
Mà : 2O3 3O2
0,4mol 0,6mol
Vậy trong 1 mol A có 1,2 mol O2
Vì tỉ lệ mol của H2/CO = 4/1
Nên trong 5 mol hỗn hợp B có 4 mol H2 và 1 mol CO
PTPỨ cháy: 2H2 + O2 2H2O 2CO + O2 2CO2
4mol 2mol 1mol 0,5mol
Suy ra tổng số mol O2 phản ứng = 2,5 mol.
Suy ra số mol hỗn hợp A cần = 2,5.1/1,2 = 2,083 mol.
(Học sinh làm cách khác nhưng đúng vẫn đạt điểm tối đa).
0,5
0,25
0,25












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



