
Trang 1/2
SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NỘI
CỤM TRƯỜNG THPT
THANH XUÂN – CẦU GIẤY
THƯỜNG TÍN – PHÚ XUYÊN
ĐỀ THI OLYMPIC CỤM NĂM HỌC 2021-2022
MÔN HÓA HỌC – LỚP 11
Thời gian làm bài: 120 phút
(Đề thi gồm 05 câu, 02 trang)
CÂU 1. (5,0 điểm) Phản xạ nhanh. Anh/chị trả lời ngắn gọn các câu hỏi dưới đây
1) Cho các phản ứng hóa học sau (a) KHCO3 + NaOH; (b) KOH + Ba(HCO3)2; (c) KOH + NaHCO3;
(d) NaHCO3 + KOH; (e) Ca(OH)2 + Ba(HCO3)2. Nêu các chữ cái đứng trước phản ứng có cùng phương
trình ion thu gọn?
2) Một dung dịch có chứa a mol Na+, b mol Mg2+, c mol Cl- và d mol
2
4
SO −
. Viết biểu thức của định luật
bảo toàn điện tích đối với dung dịch trên.
3) Cho các phát biểu sau:
(a) Trong phân tử HNO3 nguyên tử N có hoá trị V, số oxi hoá +5;
(b) Để làm khô khí NH3 có lẫn hơi nước ta dẫn khí qua bình đựng vôi sống (CaO);
(c) HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí khô;
(d) Dung dịch HNO3 để lâu thường ngả sang màu xanh do có hoà tan một lượng nhỏ khí NO2.
Chỉ ra các chữ cái đứng trước phát biểu không đúng trong các phát biểu trên?
4) Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3,
FeCO3 lần lượt phản ứng với dung dịch HNO3 đặc, nóng. Có bao nhiêu phản ứng xảy ra thuộc loại phản
ứng oxi hoá - khử? (chỉ điền số)
5) Viết dạng chung cấu hình electron lớp ngoài cùng của các nguyên tử nguyên tố thuộc nhóm IVA trong
bảng hệ thống tuần hoàn các nguyên tố hóa học?
6) Nước đá khô không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện
cho việc bảo quản thực phẩm. Nước đá khô là trạng thái rắn của chất hóa học nào?
7) Dẫn luồng khí CO dư qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 đun nóng, sau khi phản ứng xảy ra hoàn
toàn thu được hỗn hợp chất rắn gồm những chất nào?
8) Số đồng phân cấu tạo của ankin có chứa 6 nguyên tử H trong phân tử là bao nhiêu? (chỉ điền số)
9) Đốt cháy một hỗn hợp các hiđrocacbon mạch hở thuộc cùng dãy đồng đẳng thu được
22
H O CO
nn=
.
Viết công thức phân tử chung của dãy đồng đẳng trên (kèm theo điều kiện nếu có)?
10) Nêu khối lượng mol phân tử của hợp chất 2,2,3,3-tetrametylbutan là? (chỉ điền số)
CÂU 2. (5,0 điểm)
2.1. (2,0 điểm)Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau (nếu có)
a) FeCO3 + dung dịch H2SO4 (đặc, nóng, dư) b) dung dịch Ba(HCO3)2 + dung dịch NaOH dư.
c) C + S + KNO3
→
d) FeSx + HNO3 (đặc, nóng, dư)
→
(chỉ tạo muối nitrat).
2.2. (3,0 điểm) Thành phần chính của axit dạ dày là axit clohidric. Nồng độ HCl thu được trong dịch dạ dày
của người khỏe mạnh dao động từ 0,01M đến 0,1M. Axit dạ dày đóng vai trò quan trọng đối với hệ tiêu hóa,
nó thúc đẩy quá trình tiêu hóa thức ăn; tiêu diệt các vi khuẩn có hại từ bên ngoài đi vào dạ dày, tránh gây ảnh
hưởng xấu tới hệ tiêu hóa. Axit dạ dày cần đảm bảo cân bằng để ổn định quá trình tiêu hóa.
a) Tính khoảng pH của axit dạ dày của người khỏe mạnh. Khi pH dạ dày thấp hơn bình thường thì dẫn
đến chứng bệnh nào?
b) Trộn 3 dung dịch H2SO4 0,1M ; HNO3 0,2M ; HCl 0,3M với thể tích bằng nhau thu được dung dịch
A. Lấy 300 ml dung dịch A tác dụng với dung dịch B gồm NaOH 0,2M và Ba(OH)2 0,1M. Tính thể tích dung
dịch B cần dùng để sau khi phản ứng kết thúc thu được dung dịch có pH = 1. Coi Ba(OH)2 và H2SO4 phân li
hoàn toàn ở 2 nấc.
Trang 2/2
CÂU 3. (5,0 điểm)
3.1. (2,0 điểm) Giải thích các hiện tượng dưới đây và viết phương trình hóa học minh họa.
a) Trên bề mặt bể vôi thường có sự đóng váng khi để lâu ngày ngoài không khí.
b) Không dùng CO2 đề dập tắt các đám cháy của kim loại mạnh như Mg.
3.2. (3,0 điểm) Hòa tan 6,84 gam hỗn hợp gồm Mg và kim loại M (hóa trị không đổi) cần 194,44 gam dung
dịch HNO3 loãng vừa đủ thu được 0,896 lít hỗn hợp G gồm N2; N2O (dG/H2 = 16) và dung dịch T. Chia T
thành hai phần bằng nhau. Cô cạn cẩn thận phần 1 thu được 25,28 gam muối khan. Phần 2 tác dụng với
NaOH dư thu được 4,35 gam kết tủa. Các phản ứng xảy ra hoàn toàn.
Xác định kim loại M và nồng độ phần trăm các muối có trong toàn bộ dung dịch T.
CÂU 4. (2,0 điểm)
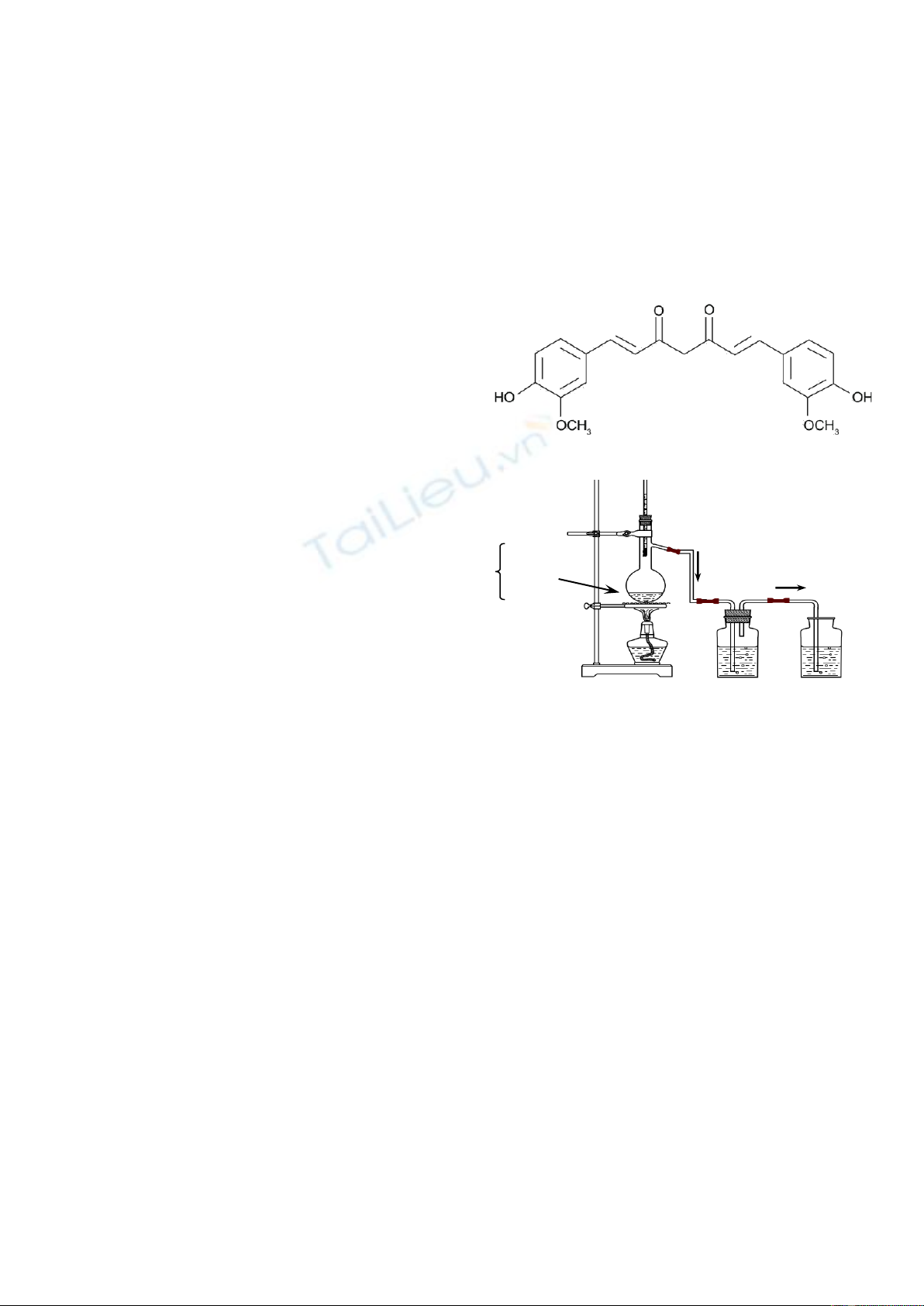
4.1. (1,0 điểm) Curcumin là thành phần chính của một
chất trong củ nghệ thuộc họ Gừng được sử dụng như
một gia vị phổ biến ở Ấn Độ. Curcumin có công thức
cấu tạo được thể hiện như hình bên.
a) Xác định công thức phân tử, công thức đơn giản nhất của curcumin.
b) Tính thành phần phần trăm theo khối lượng của O có trong curcumin.
4.2. (1,0 điểm) Cho thí nghiệm mô tả như hình vẽ sau
a) Cho biết thành phần hóa học của các chất có
trong hỗn hợp khí B1 và khí B2. Dung dịch NaOH bão
hòa có vai trò gì trong thí nghiệm bên?
b) Giả sử khí B2 sinh ra rất dư so với KMnO4, nêu
hai hiện tượng có thể quan sát được trong thí nghiệm
và viết phương trình hóa học minh họa.
CÂU 5. (3,0 điểm)
5.1. (1,0 điểm) Cho dãy chuyển hóa sau
(1) (2) (3) (4)
4 1 4 4 2 4 6
CH CH CH A (C H ) A (C H ) Cao su BuNa⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→
.
Xác định công thức cấu tạo của các hợp chất hữu cơ A1 và A2; viết phương trình hóa học, chỉ rõ điều
kiện cụ thể (nếu có) của các phản ứng trên (mỗi mũi tên ứng với một phản ứng).
5.2. (2,0 điểm) Hỗn hợp D gồm ba hiđrocacbon ở thể khí X, Y, Z (đều mạch hở, có cùng số nguyên tử H
trong phân tử) có tỉ lệ mol là 2:3:2. Tỉ khối hơi của D so với He là 10,5.
a) Xác định công thức phân tử của các chất trong D biết rằng MX + MZ = 2MY.
b) 14,7 gam hỗn hợp D trên tác dụng với 4,48 lít H2 (đktc, xt: Ni, to), sau phản ứng hoàn toàn thu được
hỗn hợp E. Hỗn hợp E làm mất màu vừa đủ V mL dung dịch Br2 1,0M. Tính V.
c) Xác định công thức cấu tạo và gọi tên thay thế của Z biết rằng Z có khả năng tạo kết tủa vàng khi tác
dụng với AgNO3/NH3. Viết phương trình hóa học của phản ứng.
Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; K = 39; Ca = 40; Fe=56; Al=27; Ag=108; Ba=137; S = 32
Thí sinh không được dùng tài liệu. cán bộ coi thi không giải thích gì thêm.
----------HẾT----------
Họ và tên thí sinh: …………………………… Số báo danh: ………………………………...
Cán bộ coi thi số 1: …………………………… Cán bộ coi thi số 2: ………………………….
dung dịch NaOH
bão hòa
dung dịch
KMnO
4
C
2
H
5
OH 96
o
H
2
SO
4
đặc
Đá bọt
Hỗn hợp
khí
B
1
Khí
B
2












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



