THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 1
THẦY CƯỜNG PLEIKU
ĐỊA CHỈ: 74A VÕ TRUNG THÀNH
SĐT: 0989 476 642
KHOA HỌC TỰ NHIÊN 7
CHỦ ĐỀ 1: NGUYÊN TỬ – NGUYÊN TỐ HÓA HỌC
PHẦN I. LÝ THUYẾT
1. Khái niệm nguyên tử
- Các chất đều được tạo nên từ những hạt vô cùng nhỏ, không thể phân chia được
nữa. Gọi là nguyên tử.
- Ta chỉ có thể quan sát được nguyên tử bằng kính hiển vi điện tử hiện đại.
- Ví dụ:
+ Đồng tiền vàng được tạo nên từ các nguyên tử vàng.
+ Khí oxygen được tạo nên từ các nguyên tử oxygen.
+ Nước được tạo nên từ các nguyên tử hydrogen và oxygen.
+ Muối ăn được tạo nên từ các nguyên tử sodium và chlorine.
- Bài tập tương tự: Các chất sau được tạo nên bởi nguyên tử nào?
+ Dây chuyền bạc.
+ Sợi dây điện bằng đồng.
+ Khí nitrogen.
+ Khí chlorine.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 2
+7
2. Mô hình nguyên tử Rutherford – Bohr
- Hai nhà bác học Ernest Rutherford
1871 1937
và Niels Bohr
1885 1962
đã đề
xuất và hoàn thiện một mô hình dùng để mô tả về nguyên tử (mà sau này gọi chung là
mô hình nguyên tử Rutherford – Bohr) như sau:
Nguyên tử có cấu tạo rỗng, hạt nhân ở tâm mang điện tích dương và các electron
mang điện tích âm chuyển động xung quanh hạt nhân tạo thành lớp vỏ. Cụ thể là
+ Hạt nhân gồm hai loại hạt nhỏ hơn là proton mang điện tích dương và
neutron không mang điện.
+ Lớp vỏ gồm các electron xếp thành từng lớp và chuyển động xung quanh hạt
nhân.
- Chú ý:
+ Mỗi electron (kí hiệu:
e
) mang một đơn vị điện tích âm và được quy ước là
1
.
+ Mỗi proton (kí hiệu:
p
) mang một đơn vị điện tích dương và được quy ước
là
1
.
+ Trong nguyên tử, số hạt proton và electron luôn bằng nhau.
p e
+ Điện tích hạt nhân bằng tổng điện tích của các hạt proton trong nguyên tử.
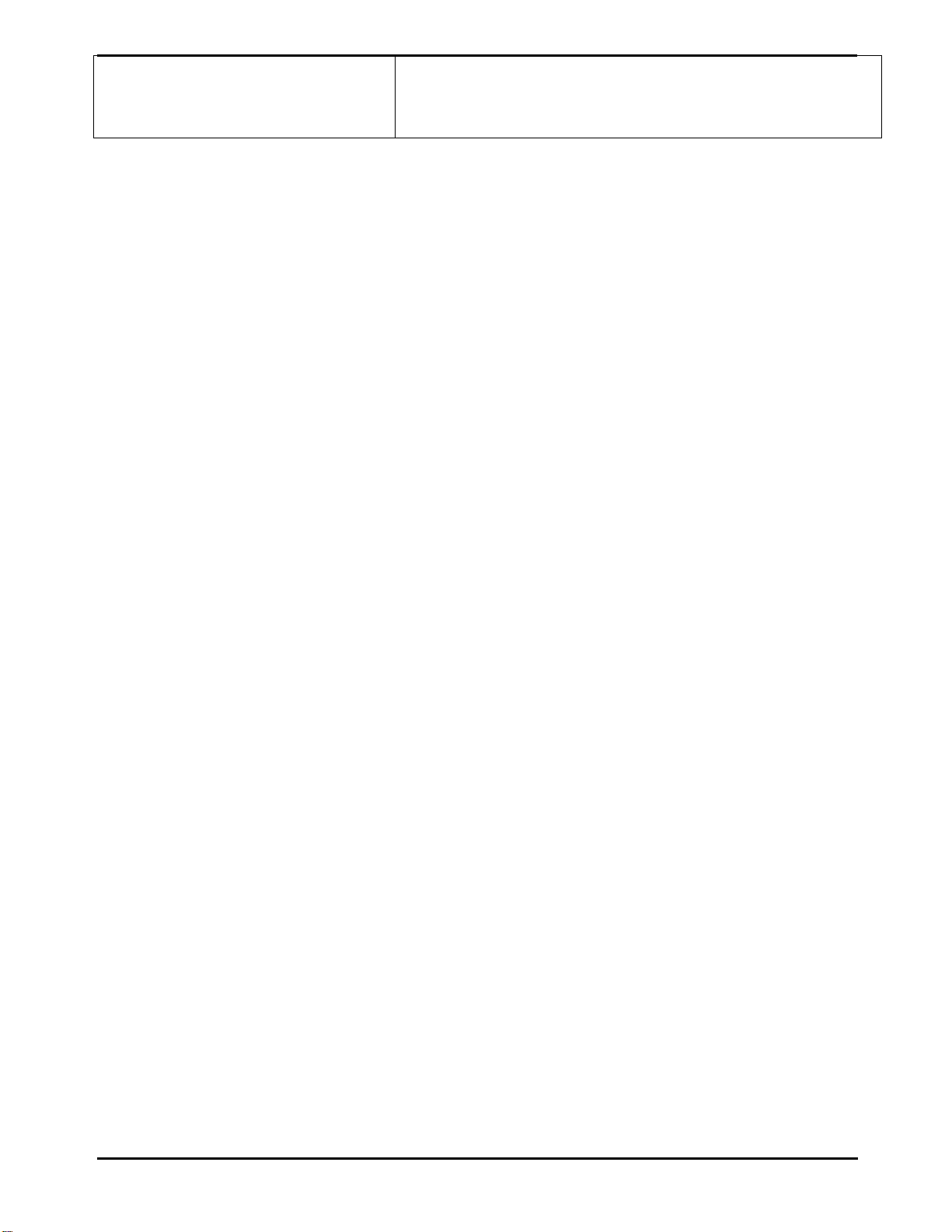
- Ví dụ: Cho mô hình cấu tạo của nguyên tử nitrogen
Nguyên tử nitrogen có điện tích hạt nhân là
7
.
Số proton Số electron Số lớp
electron
Số electron lớp
ngoài cùng
7
7
2
5
THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 3
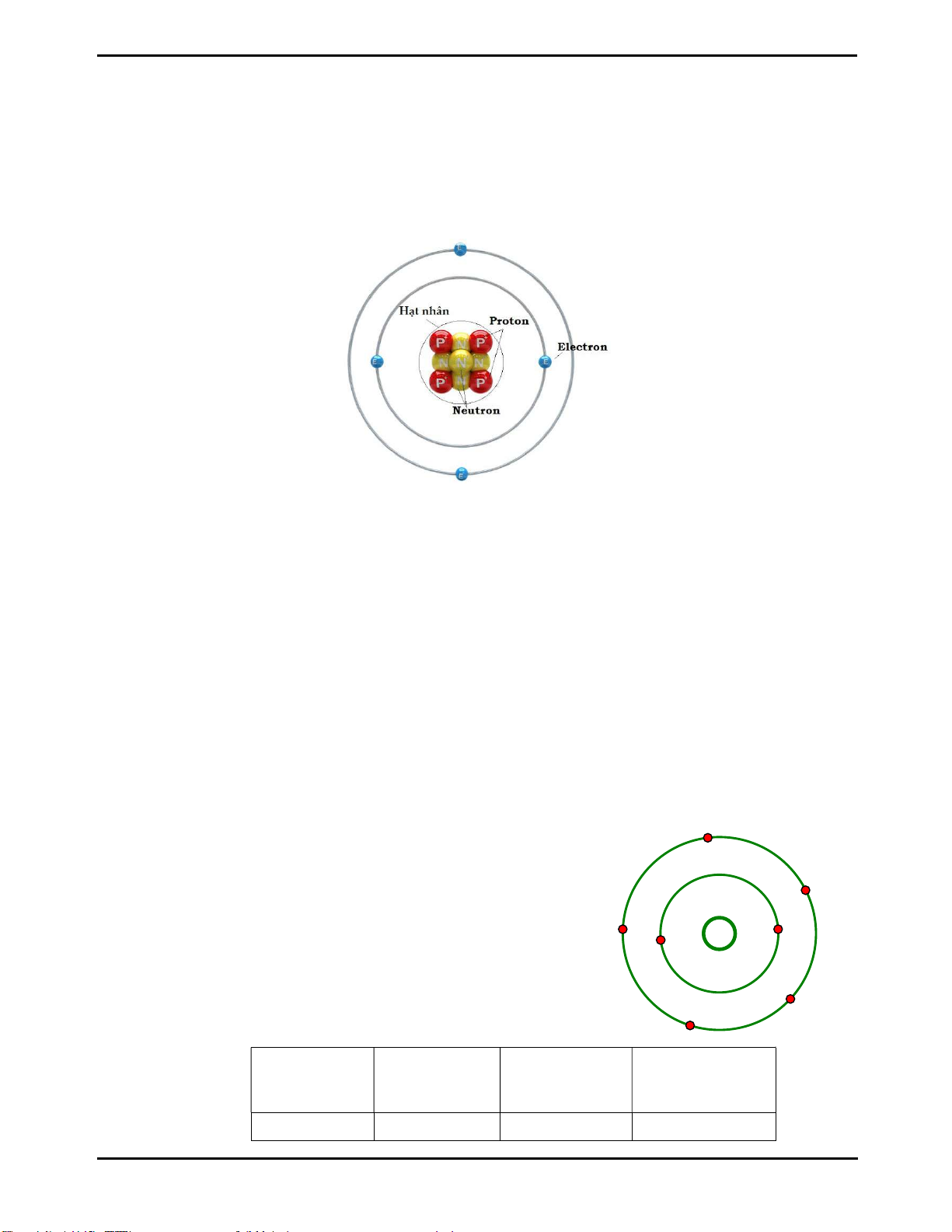
Potassium (K)
+19
- Bài tập tương tự: Cho mô hình cấu tạo của nguyên tử potassium, hoàn thành bảng
bên dưới.
Số proton Số electron Số lớp
electron
Số electron lớp
ngoài cùng
3. Vẽ mô hình nguyên tử Rutherford – Bohr
- Bước 1: Vẽ một vòng tròn nhỏ đại diện cho hạt nhân và điền vào đó giá trị của điện
tích hạt nhân.
- Bước 2: Vẽ các vòng tròn đồng tâm, mỗi vòng tròn là một lớp.
- Bước 3: Phân bố các electron theo quy tắc sau
+ Lớp thứ nhất: chứa tối đa 2
electron
.
+ Lớp thứ hai: chứa tối đa 8
electron
.
Các electron được điền vào các lớp từ trong ra ngoài cho đến khi hết số electron của
nguyên tử, lớp ngoài cùng thường chứa tối đa 8
electron
.
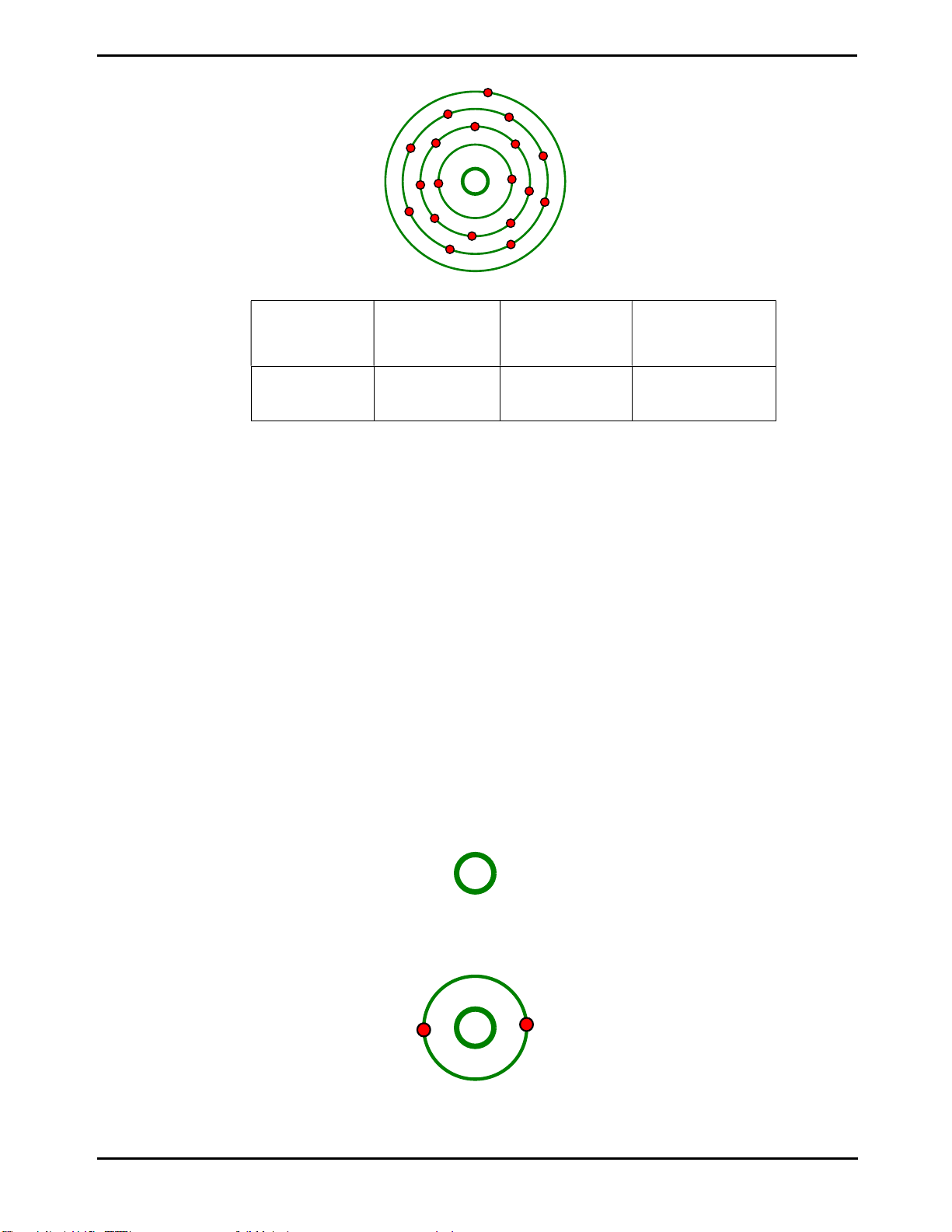
- Ví dụ: Vẽ mô hình nguyên tử Rutherford – Bohr của nguyên tử oxygen, biết điện
tích hạt nhân của nguyên tử oxygen là
8
.
Giải
Nguyên tử oxygen có 8
proton
trong hạt nhân nên cũng có 8
electron
ngoài lớp vỏ.
+ Bước 1: Vẽ hạt nhân và điền vào đó giá trị của điện tích hạt nhân là
8
+ Bước 2: Vẽ lớp electron thứ nhất và phân bố vào đó 2
electron
.
+8
+8

THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 4
+ Bước 3: Vẽ lớp electron thứ hai và phân bố vào đó 6
electron
còn lại.
Vậy nguyên tử oxygen có
2
lớp electron, lớp ngoài cùng có 6
electron
.
- Bài tập tương tự: Vẽ mô hình nguyên tử Rutherford – Bohr của các nguyên tử
a) Beryllium, biết điện tích hạt nhân của nguyên tử này là
4
.
b) Magnesium, biết điện tích hạt nhân của nguyên tử này là
12
.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
+8

THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 5
4. Khối lượng nguyên tử
- Để biểu thị khối lượng của nguyên tử, người ta dùng đơn vị khối lượng nguyên tử,
kí hiệu là
amu
, viết tắt của cụm từ
atomic mass unit
.
- Một đơn vị khối lượng nguyên tử có giá trị bằng
1
12
khối lượng nguyên tử carbon.
Ta có: 24 27
1
1 1,6605 10 1,6605 10
12 C
amu m g kg
. Trong đó
C
m
là khối lượng của
nguyên tử carbon.
+ Chuyển đổi: 24
24
1,6605 10
1,6605 10
amu gam
- Ví dụ:
+ 24 23
27 27 1,6605 10 4, 48335 10
amu g
.
+ 23
23
24
2,3247 10
2,3247 10 14
1,6606 10
g amu
.
- Bài tập tương tự: Thực hiện phép đổi đơn vị
+
15 .....
amu g
; + 23
5, 3136 10 .....
g amu
; + 26
1,9926 10 .....
kg amu
;
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt
nhân và electron ngoài lớp vỏ.
- Quy ước:
+ Khối lượng của 1
proton
và 1
neutron
xấp xỉ bằng 1
amu
.
+ Khối lượng của 1
electron
là 0, 00055
amu
.
- Chú ý: Vì khối lượng của electron rất nhỏ nên ta có thể coi khối lượng hạt nhân
nguyên tử là khối lượng của nguyên tử. (bỏ qua khối lượng của electron)
- Ví dụ: Tính khối lượng của nguyên tử oxygen ra đơn vị
amu
và đơn vị
gam
, biết
rằng nguyên tử oxygen có 8
electron
và 8
neutron
?
Giải
Trong nguyên tử, số proton bằng số electron nên
8
p e
hạt. Vậy hạt nhân của
nguyên tử oxygen có
8
hạt proton và
8
hạt neutron.
Khối lượng nguyên tử oxygen bằng: 8 8 16
amu
Đổi 24 23
16 16 1, 6605 10 2,6568 10
amu g