
CH NG IƯƠ
Đ I C NG V PROTEINẠ ƯƠ Ề
Đ NH NGHĨAỊ
Protein là h p ch t đ i phân t đ c t o thành t r t nhi u các đ n phânợ ấ ạ ử ượ ạ ừ ấ ề ơ
là axit amin. Axit amin đ c c u t o b i 3 thành ph n:ượ ấ ạ ở ầ
m t là nhóm amin (-ộNH2), hai là nhóm cacboxyl (-COOH) và cu i cùng làố
nguyên t cacbon trung tâm đính v i m t nguyên t hydro và nhóm bi n đ i Rử ớ ộ ử ế ổ
quy t đ nh tính ch t c a axit amin. ế ị ấ ủ
Protein là l p ch t b t bu c ph i có b t kỳ v t s ng nào và có t l kháớ ấ ắ ộ ả ở ấ ậ ố ỷ ệ
n đ nh. Ví d gia súc non và ng i hàm l ng protein kho ng 40 – 45% v tổ ị ụ ở ườ ượ ả ậ
ch t khô. Protein là l p ch t quan tr ng b c nh t c a s s ng, là v t mang sấ ớ ấ ọ ậ ấ ủ ự ố ậ ự
s ng.ố
Protein có trong t t c các lo i t bào v i hàm l ng khác nhau:ấ ả ạ ế ớ ượ
B ng 1.1. Hàm l ng protein trong m t s mô đ ng, th c v tả ượ ộ ố ộ ự ậ
Protein đi n hình ch a 200 – 300 axit amin, nh ng m t s protein có sể ứ ư ộ ố ố
axit amin ít h n (protein có s l ng axit amin ít nh t g i là peptit) và m t sơ ố ượ ấ ọ ộ ố
protein có s l ng axit amin l n h n (protein l n nh t đ c bi t cho đ n nay làố ượ ớ ơ ớ ấ ượ ế ế
titin trong c vân và c tim ch a t i 26.926 axit amin trong m t chu i đ n).ở ơ ơ ứ ớ ộ ỗ ơ
Đ c đi m l n nh t c a axit amin là: phân t có ch a Nit (N), kh i l ng phânặ ể ớ ấ ủ ử ứ ơ ố ượ
t l n.ử ớ
Mô Protein (% so v i kh i l ng v t ch t khô)ớ ố ượ ậ ấ
Gan 57
X ngươ 28
C vânơ80
H t lúaạ6 – 12
H t ngôạ9 – 13
Đ u nànhậ29 – 50
1

CH NG II: ƯƠ
PROTEIN LÀ N N T NG C A S S NGỀ Ả Ủ Ự Ố
Protein là n n t ng c a s s ng vì b n thân nó cũng có Axit Nucleic.ề ả ủ ự ố ả
I/ AXIT NUCLEIC
Axit Nucleic là h p ch t t nhiên cao phân t mang mã di truy n và th cợ ấ ự ử ề ự
hi n mã di truy n các sinh v t. Hàm l ng Axit Nucleic trong t bào khá cao,ệ ề ở ậ ượ ế
dao đ ng trong kho ng 5 – 15% v t ch t khô. Trong t bào có hai lo i Axitộ ả ậ ấ ế ạ
Nucleic: axit ribonucleic (RNA) và axit desoxyribonucleic (DNA).
Các đ n phân c a Axit nucleic là các nucleotit. M i nucleotit bao g m haiơ ủ ỗ ồ
thành ph n:ầ
Nucleotit = Nucleosit + Axit photphoric.
Tùy theo tr ng l ng phân t c a Axit Nucleic mà chu i nucleotit có thọ ượ ử ủ ỗ ể
dài ng n khác nhau. Trong chu i nucleotit, các nucleotit s p x p theo nh ng trìnhắ ỗ ắ ế ữ
t nh t đ nh t o nên đ c tr ng sinh h c c a Axit Nucleic, t c là t o nên các genự ấ ị ạ ặ ư ọ ủ ứ ạ
di truy n. Th t các nucleotit th ng đ c xét theo t ng b ba base. M t codonề ứ ự ườ ượ ừ ộ ộ
là m t đ n v mã di truy n, có ch c năng mã hóa cho m t axit amin. Axit Nucleicộ ơ ị ề ứ ộ
là b n thi t k protein và b ng thi t k này đ c vi t b ng các mã di truy n.ả ế ế ả ế ế ượ ế ằ ề
Th t các mã quy đ nh th t các axit amin trong protein, quy t đ nh đ c tr ngứ ự ị ứ ự ế ị ặ ư
sinh h c c a protein. M i Axit Nucleic trong quá trình hình thành và ho t đ ngọ ủ ỗ ạ ộ
luôn luôn duy trì v ng vàng trình t các nucleotit. M t r i lo n trong quá trìnhữ ự ộ ố ạ
này d n t i r i lo n tính di truy n, t c là gây nên hi n t ng bi n d . ẫ ớ ố ạ ề ứ ệ ượ ế ị
II/ C U TRÚC C A PROTEINẤ Ủ
Thành ph n nguyên t c a protein (% theo tr ng l ng)ầ ố ủ ọ ượ
C: 50 – 54; O: 20 – 23; H: 6 – 7; N: 15 - 18 (trung bình kho ng 16%); S: 0ả
- 2,4. Trong m t s protein còn ch a P, Fe, I, Co, Zn và m t s nguyên t khácộ ố ứ ộ ố ố
hàm l ng các nguyên t này r t th p nh ng có ý nghĩa r t l n đ i v i s s ng.ượ ố ấ ấ ư ấ ớ ố ớ ự ố
Đ t o nên tr ng thái s ng các nguyên t này tr c h t liên k t v i nhau t o nênể ạ ạ ố ố ướ ế ế ớ ạ
2

các axit amin ( Isoleucine, Leucine, Lysine, Methionine, Phenylalanine, Threonine,
Tryptophan, Valine, Arginine, Histidine, Cysteine, Glutamine, Glycine, Proline,
Serine, Tyrosine, Alanine, Glutamate, Asparagine, Aspartate)
Axit amin là đ n v c u t o c b n c a protein. Axit amin là nh ng d nơ ị ấ ạ ơ ả ủ ữ ẫ
xu t c a axit h u c mà trong phân t m t nguyên t hydro (đôi khi 2) c a g cấ ủ ữ ơ ử ộ ử ủ ố
ankil đ c thay th b i g c amin. Công th c chung nh sau:ượ ế ở ố ứ ư
Co thê đinh nghia khac la: axit amin g m m t nguyên t Cacbon # $ % & # ' ồ ộ ử α liên k tế
v i:ớ
•M t nguyên t Hydroộ ử
•M t nhóm Aminộ
•M t nhóm Carboxylộ
•M t trong 20 g c R, 20 g c Rộ ố ố
khác nhau t o nên 20 axit amin và quy t đ nh tính ch t đ t tr ng c a chúng. Axitạ ế ị ấ ặ ư ủ
amin hình bên là Alanin.
Axit amin là monomer c u t o nên protein. Trong t nhiên có kho ng 250ấ ạ ự ả
axit amin nh ng protein c a c th s ng ch ch a 20 axit amin g i là axit aminư ủ ơ ể ố ỉ ứ ọ
sinh protein (proteinogenic amino acids). Hình d ng và đ c tính c a protein đ cạ ặ ủ ượ
quy đ nh b i trình t và s l ng các axit amin c a protein. ị ở ự ố ượ ủ
-H+ + OH-
R-CH-COOH R-CH-COO- R-CH-COO-
NH3+ + H+ NH3+ - OH- NH2
Axit Trung tính Ki mề
3
R-CH-COOH
NH2

Trong môi tr ng trung tính phân t axit amin mang c đi n tích âm vàườ ử ả ệ
đi n tích d ngệ ươ
Trong môi tr ng ki m axit amin mang đi n tích âmườ ề ệ
Trong môi tr ng axit axit amin mang đi n tích d ngườ ệ ươ
Ng i ta ng d ng tính l ng tính c a axit amin đ phân tích h n h p axitườ ứ ụ ưỡ ủ ể ỗ ợ
amin b ng dòng đi n m t chi u (ph ng pháp đi n di).ằ ệ ộ ề ươ ệ
giá tr pỞ ị H c a môi tr ng mà axit amin có t ng s đi n tích âm b ngủ ườ ổ ố ệ ằ
đi n tích d ng (axit amin trung hòa đi n), pH đó g i là đi m đ ng đi n c a axitệ ươ ệ ọ ể ẳ ệ ủ
amin (kí hi u là pI).ệ
Các axit amin trung tính có pI kho ng 5 - 6,5 (h i axit)ả ơ
Các axit amin axit tính có pI kho ng 3 (axit rõ r t)ả ệ
Các axit amin ki m tính có pI kho ng > 7 (ki m)ề ả ề
2.1/ C u trúc b c m t c a proteinấ ậ ộ ủ
C u trúc b c 1 c a protein là s liên k t gi a các axit amin v i nhau thànhấ ậ ủ ự ế ữ ớ
chu i thông qua liên k t peptit (-CO - NH-), M ch liên k t này hình thành gi aỗ ế ạ ế ữ
nhóm COOH c a axit amin tr c v i nhóm NHủ ướ ớ 2 c a axit amin bên c nh.ủ ạ
4
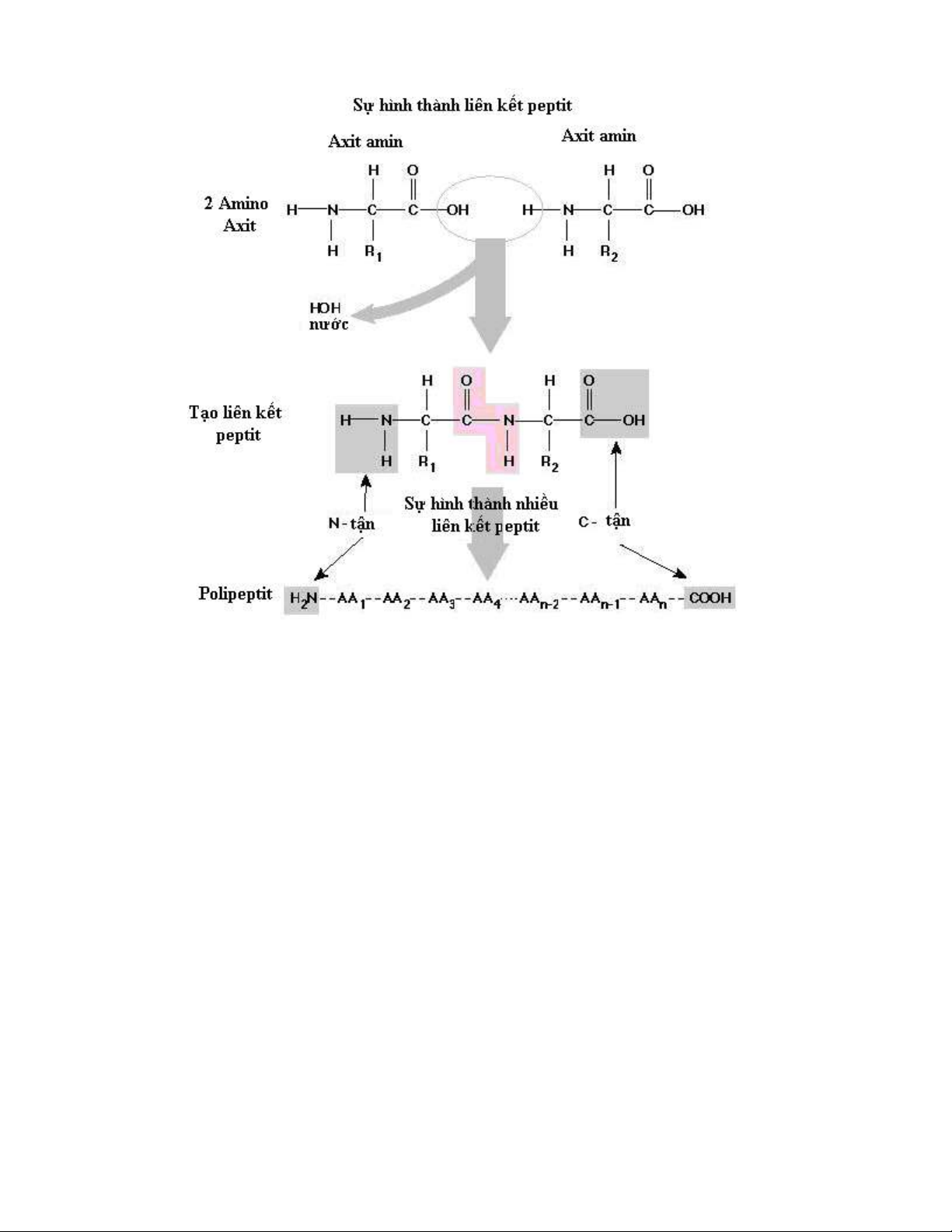
Liên k t peptit là liên k t đ ng hóa tr r t b n v ng (năng l ng phá vế ế ồ ị ấ ề ữ ượ ỡ
liên k t kho ng 6 - 7kcal/mol). Trong th c t m ch liên k t peptit r t khó th yế ả ự ế ạ ế ấ ủ
phân (ph i dùng HCl 6N v i nhi t đ ≥ 100ả ớ ệ ộ 0C).
Trong chu i peptit, các axit amin c liên k t v i nhau nh v y liên t c.ỗ ứ ế ớ ư ậ ụ
Theo quy đ nh axit amin đ u chu i (bên trái) có nhóm amin t do g i là axit aminị ầ ỗ ự ọ
N t n; axit amin cu i chu i (bên ph i) có nhóm cacboxyl t do g i là axit amin Cậ ố ỗ ả ự ọ
t n. Kho ng cách gi a nhóm -COOH và –NHậ ả ữ 2 c a các axit amin trong chu iủ ỗ
polypeptit đ c L.Pauling và c ng s dùng ph ng pháp nhi u x R ngen đượ ộ ự ươ ễ ạ ơ ể
nghiên c u.ứ
5

















![Ô nhiễm môi trường không khí: Bài tiểu luận [Nổi bật/Chi tiết/Phân tích]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251011/kimphuong1001/135x160/76241760173495.jpg)







