
Tóm tăt lý thuyết hoá học 11
Trường THPT Số 1 Nghĩa Hành Tháng 05/ 2010
Giáo viên Chu Anh Tuấn Trang 15
Chương II : NITƠ – PHOT PHO
A. Giới thiệu chung
I. Vị trí.
Thuộc nhóm V trong bảng hệ thống tuần hoàn.
- Nhóm Nitơ gồm : Nitơ (N) , Photpho (P) , Asen(As) , atimon (Sb) và bitmut (Bi).
- Chúng đều thuộc các nguyên tố p .
II. Tính chất chung các nguyên tố nhóm nitơ.
1. Cấu hình electron của nguyên tử :
- Cấu hình lớp electron ngoài cùng : ns2np3
ns2 np3
- Ở trạng thái cơ bản , nguyên tử của các nguyên tố nhóm nitơ có 3 electron độc thân , do đó trong
các hợp chất chúng có cộng hóa trị là 3 .
- Đối với các nguyên tố : P , As , Sb ở trạng thái kích thích có 5 elctron độc thân nên trong hợp chất
chúng có liên kết cộng hóa trị là 5 ( Trừ Nitơ ).
2 . Sự biến đổi tính chất của các đơn chất :
a. Tính oxi hóa khử :
- Trong các hợp chất chúng có các số oxi hoá : -3 , +3 , +5 . Riêng Nitơ còn có các số oxi hoá : +1 ,
+2 , +4 .
- Các nguyên tố nhóm Nitơ vừa có tính oxi hoá vừa có tính khử .
- Khả năng oxi hóa giảm từ nitơ đến bitmut .
b. Tính kim loại - phi kim :
- Đi từ nitơ đến bitmut , tính phi kim của các nguyên tố giảm dần , đồng thời tính kim loại tăng dần
3. Sự biến đổi tính chất của các hợp chất :
a. Hợp chất với hiđro : RH3
- Độ bền nhiệt của các hiđrua giảm từ NH3 đến BiH3 .
- Dung dịch của chúng không có tính axít .
b. Oxit và hiđroxit :
- Có số oxi hoá cao nhất với ôxi : +5
- Độ bền của hợp chất với số oxihoá +5 giảm xuống
- Với N và P số oxi hóa +5 là đặc trưng .
- Tính bazơ của các oxit và hiđroxit tăng còn tính axit giảm Theo chiều từ nitơ đến bitmut.
B. Nitơ
I –Cấu tạo phân tử.
- Công thức electron : : N :::N :
- Công thức cấu tạo : : N N :
II – Tính chất vật lý.
- Là chất khí không màu , không mùi , không vị , hơi nhẹ hơn không khí , hóa lỏng ở - 196 0C, hóa
rắn:-210 0C
- Tan rất ít trong nước , không duy trì sự cháy và sự sống, không độc.
III . Tính chất hoá học.
- Nitơ có các số oxi hoá : -3 0 +1 +2 +3 +4 +5
.

Tóm tăt lý thuyết hoá học 11
Trường THPT Số 1 Nghĩa Hành Tháng 05/ 2010
Giáo viên Chu Anh Tuấn Trang 16
tính oxi hoá tính khử .
-N2 có số oxihoá 0 nên vừa thể hiện tính oxi hoá và tính khử .
- Nitơ có ENN = 946 kJ/mol , ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao
hoạt động hơn .
- Nitơ thể hiện tính oxi hóa và tính khử , tính oxi hóa đặc trưng hơn .
1 . Tính oxi hóa :
a. Tác dụng với hiđro :
Ở nhiệt độ cao (4000C) , áp suất cao và có xúc tác :
N20 + 3H2
2
-3
N
H3 ; H = - 92kJ
b. Tác dụng với kim loại :
6Li + N20 2 Li3N
( Liti Nitrua )
3Mg + N2 Mg3N2
(Magie Nitrua )
2 . Tính khử :
- Ở nhiệt độ 30000C (hoặc hồ quang điện ) :
N20 + O2
2NO . H=180KJ
Nitơ thể hiện tính khử .
- Khí NO không bền :
2
2
N
O + O2
2
4
N
O2
- Các oxit khác như N2O , N2O3 , N2O5 không điều chế trực tiếp từ nitơ và oxi .
Kết luận :
Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn .Thể hiện tính oxihóa
khi tác dụng với các nguyên tố có độ âm điện lớn hơn .
IV. Trạng thái thiên nhiên và điều chế .
1. Trạng thái thiên nhiên :
- Ở dạng tự do : chiếm khoảng 80% thể tích không khí , tồn tại 2 đồng vị :14N (99,63%) ,
15N(0,37%) .
- Ở dạng hợp chất , nitơ có nhiều trong khoáng vật NaNO3 (Diêm tiêu ) : cò có trong thành phần
của protein , axit nucleic , . . . và nhiều hợp chất hữu cơ thiên nhiên .
2 – Điều chế.
a. Trong công nghiệp :
- Chưng cất phân đoạn không khí lỏng , thu nitơ ở -196 0C , vận chuyển trong các bình thép , nén
dưới áp suất 150 at .
b. Trong phòng thí nghiệm :
- Đun dung dịch bão hòa muối amoni nitrit ( Hỗn hợp NaNO2 và NH4Cl ) :
NH4NO2
0t
N2 + 2H2O .
V – Ứng dụng.
- Là một trong những thành phần dinh dưỡng chính của thực vật .
- Trong công nghiệp dùng để tổng hợp NH3 , từ đó sản xuất ra phân đạm , axít nitríc . . . Nhiều
nghành công nghiệp như luyện kim , thực phẩm , điện tử . . . Sử dụng nitơ làm môi trường .
VI. Oxit của nitơ
Tóm tăt lý thuyết hoá học 11
Trường THPT Số 1 Nghĩa Hành Tháng 05/ 2010
Giáo viên Chu Anh Tuấn Trang 17
1. Đinitơ oxit ( khí cười ): N2O
Công thức cấu tạo : N≡N →O
Điều chế : NH4NO3
250 C
o
N2O + 2H2O
2. Nitơ oxit : NO
Công thức cấu tạo : .N ═ O
Điều chế : Cu +HNO3 loãng →Cu(NO3)2 + NO + H2O
hoặc NH3 + O2
o
t
Pt
NO + H2O
3. Nitơđioxit: NO2 ( màu nâu, rất độc )
Công thức cấu tạo : O - N═O
Điều chế : Cu + HNO3 đặc, nóng →Cu(NO3)2 + NO2 + H2O
4. Đinitơ pentoxit: N2O5
Công thức cấu tạo : O = N - O – N = O
↓ ↓
O O
Điều chế: HNO3 + P2O5
dkt
HPO3 + N2O5
C. Amoniac
I . Cấu tạo phân tử
- CT e CTCT
H : N : H H – N – H
H H
N
•
H H
H
- Liên kết trong phân tử NH3 là liên kết cộng hoá trị phân cực , nitơ tích điện âm , hiđro tích điện
dương do đó phân tử NH3 là phân tử phân cực .
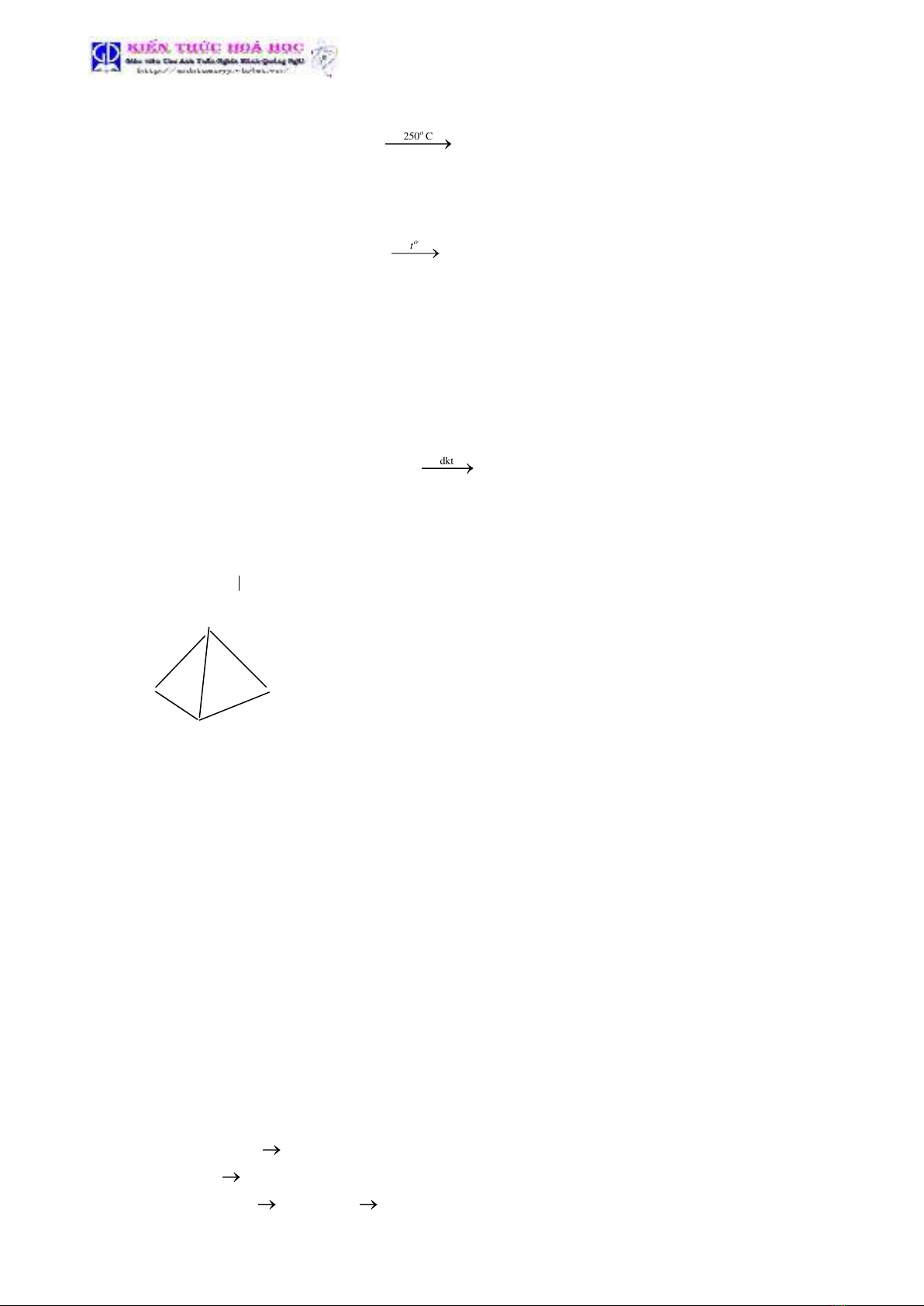
-Phân tử NH3 có cấu tạo hình tháp , đáy là một tam giác đều
II . Tính chất vật lí.
- Nhẹ hơn không khí .
- Là chất khí không màu , mùi khai và xốc , nhẹ hơn không khí .
- Khí NH3 tan rất nhiều trong nước , tạo thành dung dịch amoniac có tính kiềm yếu .
III. Tính chất hoá học
1 . Tính bazơ yếu :
a. Tác dụng với nước :
- Dựa vào tính chất hóa chung của bazơ
- Dựa vào thuyết axít – bazơ của bronxted viết phương trình điện li của NH3 trong nước .
Trong dung dịch NH3 là một bazơ yếu , ở 250C , Kb = 1,8. 10-5
NH3 + H2O
NH4+ + OH-
b. Tác dụng với axít : Tạo thành muối amoni .
Vídụ: 2NH3 + H2SO4 (NH4)2SO4
NH3 + H+ NH4+ .
NH3(k) + HCl(k) NH4Cl(r ) . Phản ứng dùng để nhận biết khí NH3 .

Tóm tăt lý thuyết hoá học 11
Trường THPT Số 1 Nghĩa Hành Tháng 05/ 2010
Giáo viên Chu Anh Tuấn Trang 18
Kết luận :
- Amoniac ở trạng thái khí hay trong dung dịch đều thể hiện tính bazơ yếu .Tác dụng với axít tạo
thành muối amoni và kết tủa được hiđroxit của nhiều kim loại .
c. Tác dụng với dung dịch muối của nhiều kim loại , tạo kết tủa hiđroxit của chúng .
Ví dụ : Al3++3NH3+3H2O Al(OH)3 + 3NH4+
2
Fe
+2NH3+2H2O Fe(OH)2+2NH4+
2 . Khả năng tạo phức :
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại , tạo thành
các dung dịch phức chất
Ví dụ :
* Với Cu(OH)2: Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
- Phương trình ion : Cu(OH)2 + 4NH3 [Cu(NH3)4]2++ 2OH-
Màu xanh thẫm
* Với AgCl . AgCl + 2NH3 [Ag(NH3)2] Cl
AgCl + 2NH3 [Ag(NH3)2]+ + Cl-
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng cá electron chưa sử dụng của
nguyên tử nitơ với ion kim loại
3 . Tính khử :
- Amoniac có tính khử : phản ứng được với oxi , clo và khử một số oxit kimloại (Nitơ có số oxi hóa
từ -3 đến 0, +2 ).
a. Tác dụng với oxi :
- Amoniac cháy trong không khí với ngọn lửa màu lục nhạt :
4NH3 +3O2 2N02 + 6H2O .
- Khi có xúc tác là hợp kim platin và iriđi ở 850 – 9000C :
4NH3 +5O2 4NO + 6H2O .
b. Tác dụng với clo :
- Khí NH3 tự bốc cháy trong khí Clo tạo ngọn lửa có khói trắng :
2NH3 + 3Cl2 N20 +6HCl .
- Khói trắng là những hạt NH4Cl sinh ra do khí HCl vừa tạo thành hóa hợp với NH3 .
c. Tác dụng với một số oxit kim loại:
- Khi đun nóng , NH3 có thể khử oxit của một số kim loại thành kim loại
Ví dụ : 2NH3 + 3CuO
o
t
3Cu +N20 +3H2O
IV. ĐIỀU CHẾ :
1. Trong phòng thí nghiệm :
- Cho muối amoni tác dụng với kiềm nóng :
2NH4Cl+Ca(OH)2 2NH3 + CaCl2 +2H2O
- Đun nóng dung dịch amoniac đặc .
2 . Trong công nghiệp:
N2(k) + 3H2(k)
2NH3 ∆H = - 92 kJ
Với nhiệt độ : 450 – 5000C .
Áp suất : 300 – 1000 at
Chất xúc tác : Fe hoạt hóa , tăng áp suất để thu lượng NH3 nhiều.

Tóm tăt lý thuyết hoá học 11
Trường THPT Số 1 Nghĩa Hành Tháng 05/ 2010
Giáo viên Chu Anh Tuấn Trang 19
* Thực hiện ở t° thấp . Tuy nhiên t° thích hợp khoản 440°C
* Dùng chất xúc tác .
V. Muối Amoni
1. Tính chất vật lí
- Là những hợp chất tinh thể ion , Phân tử gồm cation NH4+ và anion gốc axit .
- Muối amoni đều dễ tan trong nước và khi tan điện ly hoàn toàn thành các ion .
Ví dụ : NH4Cl NH4+ + Cl - ; Ion NH4+ không có màu .
2. Tính chất hoá học
a. Phản ứng thuỷ phân : Tạo môi trường có tính axit làm quỳ tím hoá đỏ
NH4+ + HOH NH3 + H3O+ ( Tính axit )
b . Phản ứng trao đổi ion :
Ví dụ: (NH4)2SO4+ 2 NaOH 2NH3↑ + Na2SO4 + 2H2O . (1)
NH4+ + OH- → NH3↑ +H2O
Phản ứng này dùng để điều chế NH3 trong phòng thí nghiệm.
NH4Cl +AgNO3 AgCl↓ + NH4NO3 (2)
Cl- +Ag+ AgCl ↓.
Các phản ứng trên là phản ứng trao đổi .
c – Phản ứng nhiệt phân :
Khi đun nóng các muối amoni dễ bị nhiệt phân , tạo thành những sản phẩm khác nhau .
Muối amoni tạo bởi axít không có tính oxihóa :
Khi đun nóng bị phân hủy thành amoniac và axit
Ví dụ : NH4Cl(r ) NH3(k) + HCl(k) .
HCl + NH3 NH4Cl
(NH4)2CO3 NH3 +NH4HCO3
NH4HCO3 NH3 +CO2 + H2O
Muối tạo bởi axít có tính oxihóa :
- Như axít nitrơ , axít nitric khi bị nhiệt phân cho ra N2 hoặc N2O và nước .
Ví dụ :
NH4NO2 N2 + 2H2O .
NH4NO3 N2O + 2H2O .
-Về nguyên tắc : tuỳ thuộc vào axit tạo thành mà NH3 có thể bị oxi hoá thành các sản phẩm khác
nhau .
D.Axit nitric
I – Cấu tạo phân tử
- CTPT : HNO3
- CTCT : H – O – N O
║
O
- Nitơ có hóa trị IV và số oxihoá là +5
II – Tính chất vật lí
- Là chất lỏng không màu
- Bốc khói mạnh trong không khí ẩm
- D = 1,53g/cm3 , t0s = 860C .


















