7
Tạp chí phân tích Hóa, Lý và Sinh học - Tập 29, số 04/2023
TỔNG HỢP MnFe2O4 CÓ KÍCH THƢỚC NANO VÀ KHẢ NĂNG LOẠI BỎ
Pb2+ RA KHỎI DUNG DỊCH NƢỚC
Đến toà soạn 30-09-2023
Nguyễn Nho Dũng1, Nguyễn Thanh Bình2,3, Trần Mai Giang4, Nguyễn Mậu Thành5*
1. Trường Đại học Thể dục Thể thao Đà Nẵng
2. Viện Nghiên cứu Hạt nhân, Đà Lạt
3. Trường Đại học Khoa học, Đại học Huế
4. Sở Khoa học và Công nghệ tỉnh Quảng Bình
5. Trường Đại học Quảng Bình
*Email: thanhnm@quangbinhuni.edu.vn
SUMMARY
SYNTHESIS OF MnFe2O4 NANOPARTICLES AND THE ABILITY TO REMOVE Pb2+
FROM AQUEOUS SOLUTION
In the present paper, nanosized manganese ferrite material was synthesized by the hydrothermal method.
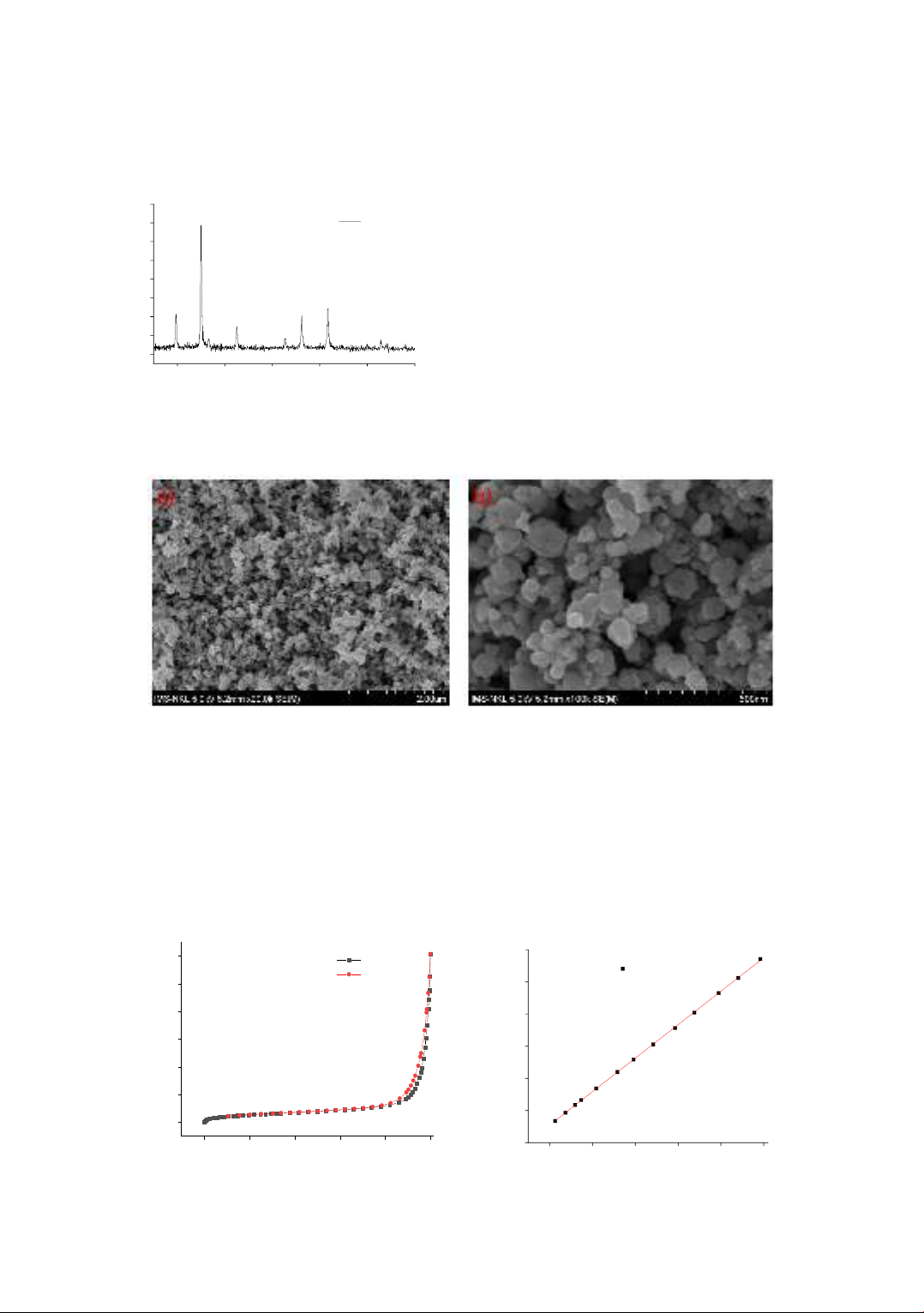
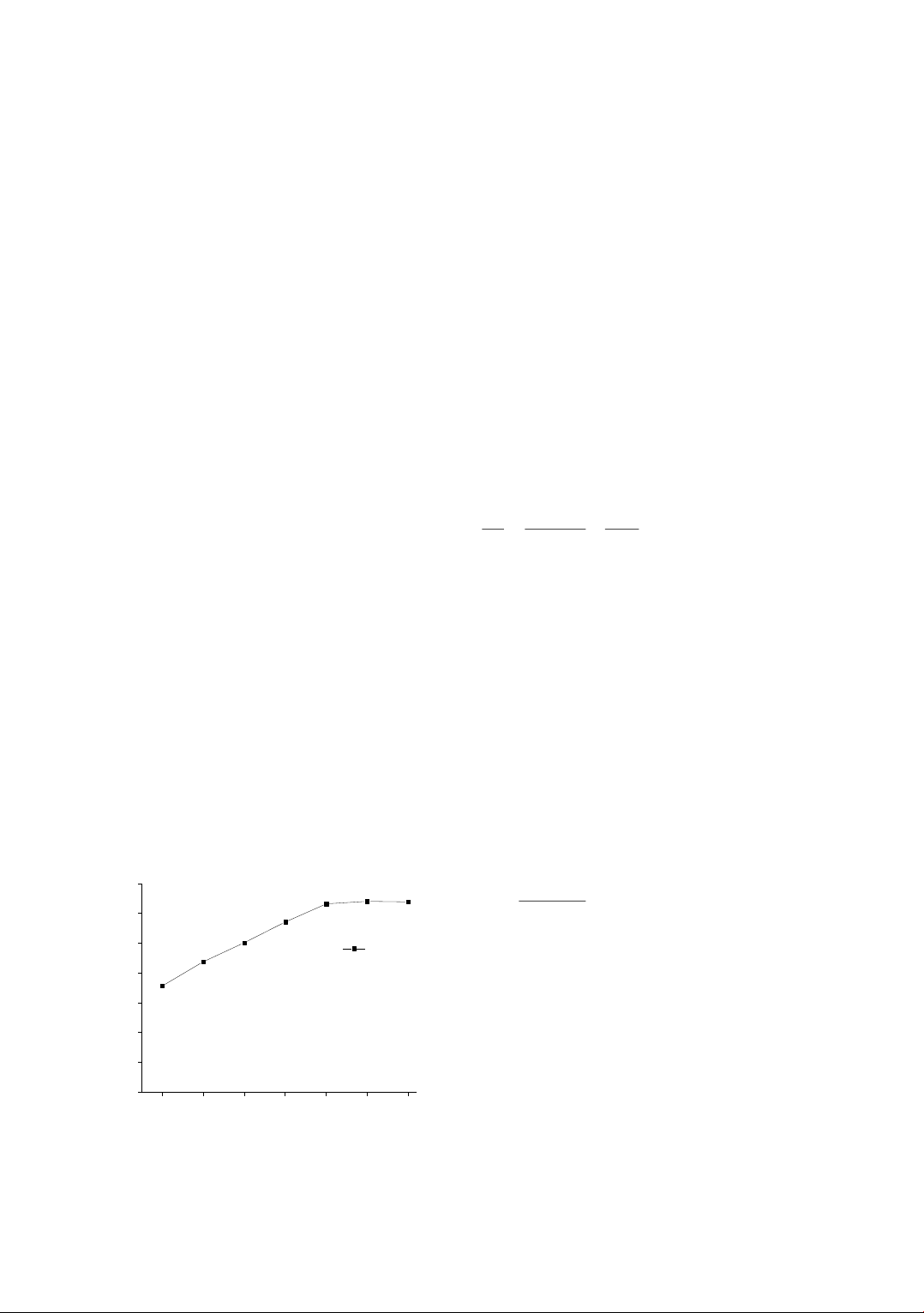
The size and microstructure of MnFe2O4 were analyzed based on X-ray diffraction (XRD), scanning electron
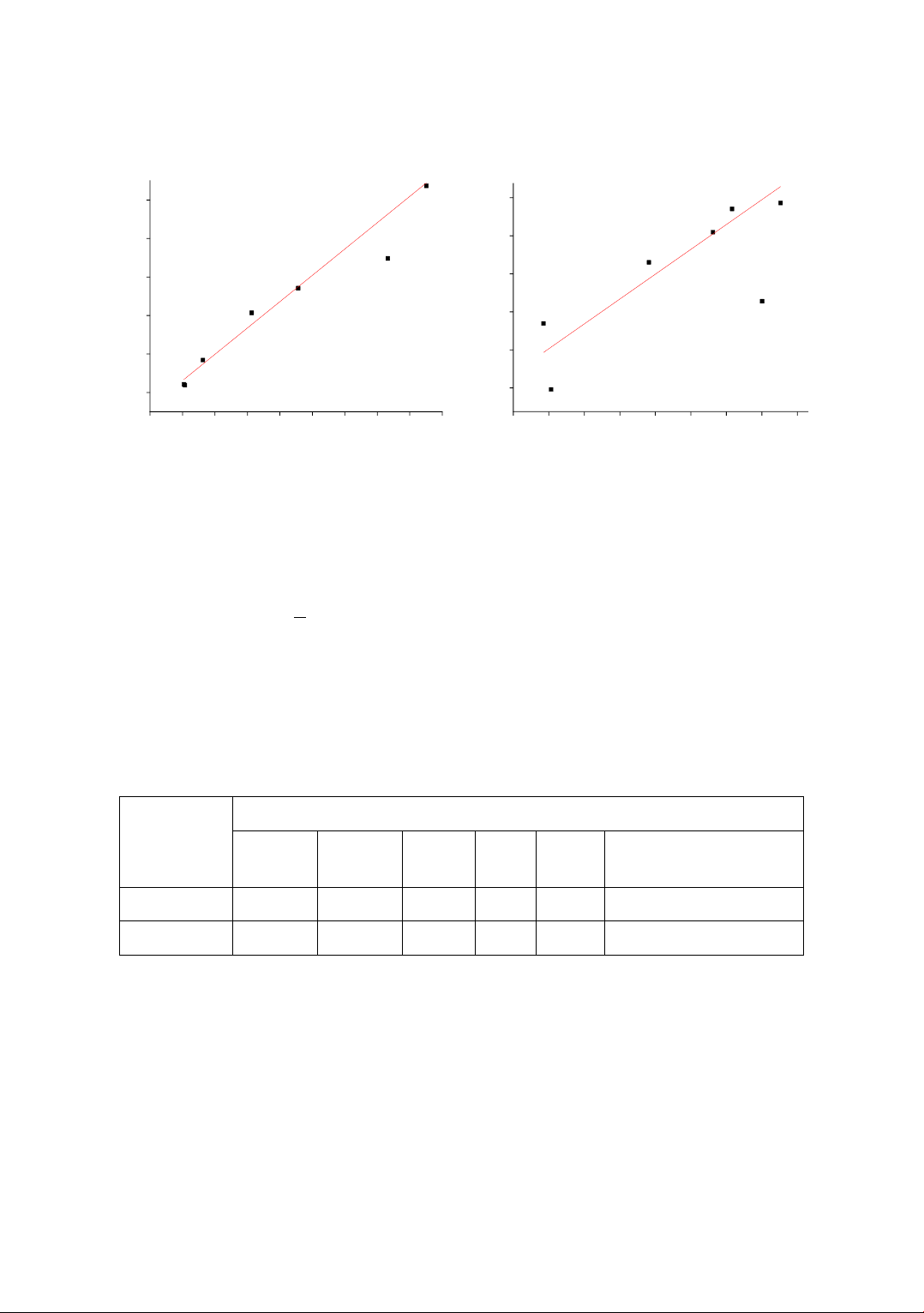
microscopy (SEM). The nitrogen adsorption-desorption was used for determination of surface area
(Brunauer – Emmett – Teller (BET)) and porosity of the fabricated material. The adsorption behavior of
Pb2+ using a new magnetic adsorbent was investigated. The adsorption characteristic and Pb2+ removal
efficiency of the adsorbent were determined by investigating the influence of operating variables such as
dosage of manganese ferrite. The maximum Pb2+ sorption capacity was found to be 7.32 (mg/g) and
obtained using 0.5 g/L MnFe2O4 at pH 5, temperature of 25 °C, and contact time as 24 h. The Langmuir and
Freundlich models were used to fit the experimental data and these showed good correlations.
Keywords: Nanosized MnFe2O4, adsorption, Pb2+, Langmuir and Freundlich models.
1. MỞ ĐẦU
Từ thế kỷ trước, quá trình công nghiệp hóa ngày
càng mạnh mẽ đã gây áp lực lớn lên môi trường.
Luyện kim, đúc thép, xi măng, đốt rác, bảo dưỡng ô
tô, quá trình lọc dầu và sản xuất pin đã tạo ra một
lượng lớn chì (Pb), gây ô nhiễm nước. Pb là một
nguyên tố độc và có hại, trọng lượng phân tử cao,
và trong số các kim loại nặng thì nó có sự phân bố
nhiều nhất trên toàn cầu. Gần đây, ô nhiễm Pb
trong nguồn nước đã trở thành một vấn đề cấp bách
ở các nước đang phát triển [1]. Vì vậy, loại bỏ Pb ra
khỏi nguồn nước là một nhiệm vụ quan trọng và
cần thiết để đảm bảo tính mạng và sức khỏe của
con người. Trong những năm gần đây, nhiều kỹ
thuật đã được phát triển để loại bỏ Pb khỏi nước
thải, chẳng hạn như trao đổi ion, quy trình màng,
kết tủa hóa học, lọc và hấp phụ [2], … Trong số các
phương pháp này, hấp phụ là một trong những công
nghệ loại bỏ phổ biến nhất và đã thu hút được sự
chú ý rộng rãi do ưu điểm của nó là chi phí thấp,
quy trình đơn giản và hiệu quả loại bỏ cao. Nhiều
chất hấp phụ đã được sử dụng để loại bỏ kim loại
nặng khỏi dung dịch nước. Các chất hấp phụ truyền
thống có thể không được ưa chuộng do chi phí sản
xuất và tái sinh cao, trong khi vật liệu có kích thước
nano là vật liệu hiệu quả để loại bỏ Pb khỏi nước và
đã được chú ý rộng rãi [3]. Quá trình tổng hợp hạt
nano đã thu hút được nhiều sự chú ý do diện tích bề
mặt cao, tính chất điện và từ dẫn đến tiềm năng hấp
phụ tuyệt vời. Gần đây, các hạt nano oxid kim loại
đã thu hút nhiều sự chú ý trong việc loại bỏ các kim
loại nặng, các chất ô nhiễm hữu cơ và vô cơ khỏi
nguồn nước, chẳng hạn như alumin, hạt nano oxid
sắt, hạt nano oxid mangan [4],…... Bên cạnh đó,
các hạt nano mangan ferit (MnFe2O4) là một spinel
đảo một phần với khoảng 80% các ion Mn2+ nằm ở
vị trí tứ diện, trong khi chỉ có 20% trong số chúng