
50
Chương 4
Giản đồ thế điện cực -pH
4.1 Mở đầu
Giản đồ thế điện cực - pH trình bày sự phụ thuộc của giá trị thế điện cực vào giá trị pH
của môi trường phản ứng. Giản đồ này được xây dựng trên cơ sở các số liệu nhiệt động học và
cho phép giải thích trạng thái tồn tại, tính chất của đơn chất và hợp chất cũng như khả năng
chuyển hoá giữa các chất có trong hệ khảo sát.
Sự ăn mòn kim loại theo cơ chế điện hoá xảy ra trong môi trường nước luôn gắn liền với
hai quá trình: sự oxi hoá kim loại tại anot chuyển kim loại thành ion kim loại và luôn gắn liền
với phản ứng khử xảy ra trên catot - sự khử ion 3
HO
+
có trong dung dịch hoặc khử oxi hoà tan
trong dung dịch hoặc khử nước.
Mặt khác, sự ăn mòn kim loại theo cơ chế điện hoá phụ thuộc vào giá trị thế điện cực của
anot và catot. Trong môi trường nước các giá trị thế điện cực có phụ thuộc vào pH. Vì vậy
việc xây dựng giản đồ thế điện cực cân bằng - pH là cần thiết và gọi tắt là giản đồ thế điện
cực - pH (E - pH).
M. Pourbaix là người đầu tiên đưa ra giản đồ này (1945) và còn gọi là giản đồ M.
Pourbaix.
4.2 Cơ sở số liệu để xây dựng giản đồ E - pH
Giản đồ thế điện cực E - pH của các hệ kim loại (hoặc oxit kim loại) tiếp xúc với môi
trường chất điện li (dung môi nước) ở dạng đơn giản hoặc phức tạp đều dựa trên các loại đoạn
thẳng ứng với các phản ứng xảy ra sau đây trong hệ khảo sát (hệ ăn mòn kim loại do môi
trường chất điện li).
1.10.1 Hệ oxi hoá khử thuần tuý
Phản ứng oxi hoá khử không có sự tham gia của ion 3
HO
+
và chỉ trao đổi electron:
Ví dụ: Ox + ne U Red
Fe3+ + 1e U Fe2+ (4.1)
Trong trường hợp này giá trị thế điện cực E được tính theo phương trình Nernst (ở 25oC)
và không phụ thuộc pH.
E = Eo + 0,059
nlg Ox
Re d
a
a (4.2)

51
Đối với (4.1): 32
Fe / Fe
E++
= Eo + 0,059
1lg 3
2
Fe
Fe
a
a
+
+
hoặc: 32
Fe / Fe
E++
= 0,77 + 0,059
1lg 3
2
Fe
Fe
a
a
+
+
(4.3)
Khi tỉ số 3
2
Fe
Fe
a
a
+
+
= 1 thì 32
Fe / Fe
E++
= Eo = 0,77 V (SHE).
Khi biểu diễn giá trị thế này vào pH trên giản đồ E - pH (hình 4.1a) ta được một họ
đường thẳng song song với trục hoành với các giá trị thế khác nhau.
Hình 4.1
Sự phụ thuộc của giá trị thế điện cực E và pH (E - pH)
a) Đối với hệ oxi hoá khử thuần tuý; b) Đối với hệ axit - bazơ thuần tuý;
c) Đối với hệ hỗn hợp của (a) và (b).
1.10.2 Hệ axit - bazơ thuần tuý
Phản ứng xảy ra trong hệ khảo sát chỉ có sự trao đổi proton 3
HO
+
và không có sự trao đổi
electron:
Mez+ + z
2H2O U MeOz/2 + zH+ (4.4)
Ví dụ:
Cu2+ + H2O U CuO + 2 H+ (4.5)
Hằng số cân bằng Kcb = K của phản ứng (4.4):
K =
z
z
H
Me
a
a
+
+

52
z
H
a+ = K. z
Me
a
+
Vậy: pH = 1
nlg
z
Me
1
K.a
+
(4.6)
Áp dụng phương trình (4.6) tính pH cho phản ứng (4.5) ta có:
K =
2
2
H
Cu
a
a
+
+
= 1,45.10−8
và pH = 1
2lg 8
1
1,45.10 + 1
2lg
2
Cu
1
a
+
pH =
1
2lg1,45.10–8 – 1
2lg 2
Cu
a
+
, khi 2
Cu
a
+
= 1; pH = 3,9
Từ phương trình (4.6) cho thấy giá trị pH của phản ứng (4.5) không phụ thuộc vào thế
điện cực. Trên giản đồ E - pH (hình 4.1) họ đoạn thẳng song song với trục tung thể hiện pH
không phụ thuộc thế điện cực.
1.10.3 Hệ phản ứng hỗn hợp - Có sự trao đổi electron và có mặt ion 3
HO
+ tham gia
phản ứng
Xét phản ứng:
νj Mj + mH+ + ze U /
j
ν Mj’ + m
2H2 (4.7)
Ví dụ:
Mn7+ + 8H+ + 5e U Mn5+ + 4H2O (4.8)
trong đó: νj = /
j
ν = 1, μj = Mn7+ và Mj’ = Mn5+
Áp dụng phương trình Nernst cho phản ứng (4.7):
E = Eo + RT
zF ln
j
j
/
j
/2
j
m
H
m/2
HO
a.a
a.a
+
ν
μ
ν
μ
E = Eo – RT
zF lnK – 2,303 RT
zF .m.pH
hoặc E = a – bpH
(4.9)
trong đó: a = Eo – RT
zF lnK và b = 2,303 RT
zF .m
Ở 25oC ta có: b = 0,059 m
z

53
Đối với phản ứng (4.8) hệ số b = 0,059 m
n (ở 25oC).
Từ phương trình (4.9) giá trị thế điện cực phục thuộc vào pH và trên đồ thị E - pH (hình
4.1c) quan hệ đó được thể hiện bằng họ đoạn thẳng có độ dốc b = – 0,059 m
z.
4.3 Một số giản đồ E - pH (giản đồ M. Pourbaix)
4.3.1 Giản đồ của nước tinh khiết ở 25oC
Việc nghiên cứu giản đồ E - pH của nước rất có ý nghĩa đối với sự ăn mòn kim loại theo
cơ chế điện hoá.
Nước là một chất điện li rất yếu:
2H2O U 3
HO
+
+ OH− (4.10)
Vì vậy nồng độ H+ và OH− rất nhỏ, trong nước có một lượng khí O2 hoà tan (để đơn giản
thay OH3
+ bằng H+).
Các phương trình oxi hoá khử có liên quan đến H+, OH− và H2O:
2H+ + 2e U H2 (4.11)
2H2O + 2e U H2 + 2OH− (4.12)
Phản ứng (4.11) và (4.12) là các phản ứng điện hoá dạng hỗn hợp.
Phương trình Nernst áp dụng cho phản ứng (4.11) có dạng:
Ở 25oC:
2
2H / H
E + =
2
o
2H / H
E + + 0,059
2lg
2
2
H
H
a
P
+
Nếu áp suất của H2 2
H
P = 1 atm ta có:
2
2H / H
E + = – 0,059 pH (4.13)
Phương trình này cũng đúng cho phản ứng (4.12).
Trên giản đồ E - pH (xem hình 4.2), phương trình (4.13) được thể hiện trên đoạn thẳng
OA..
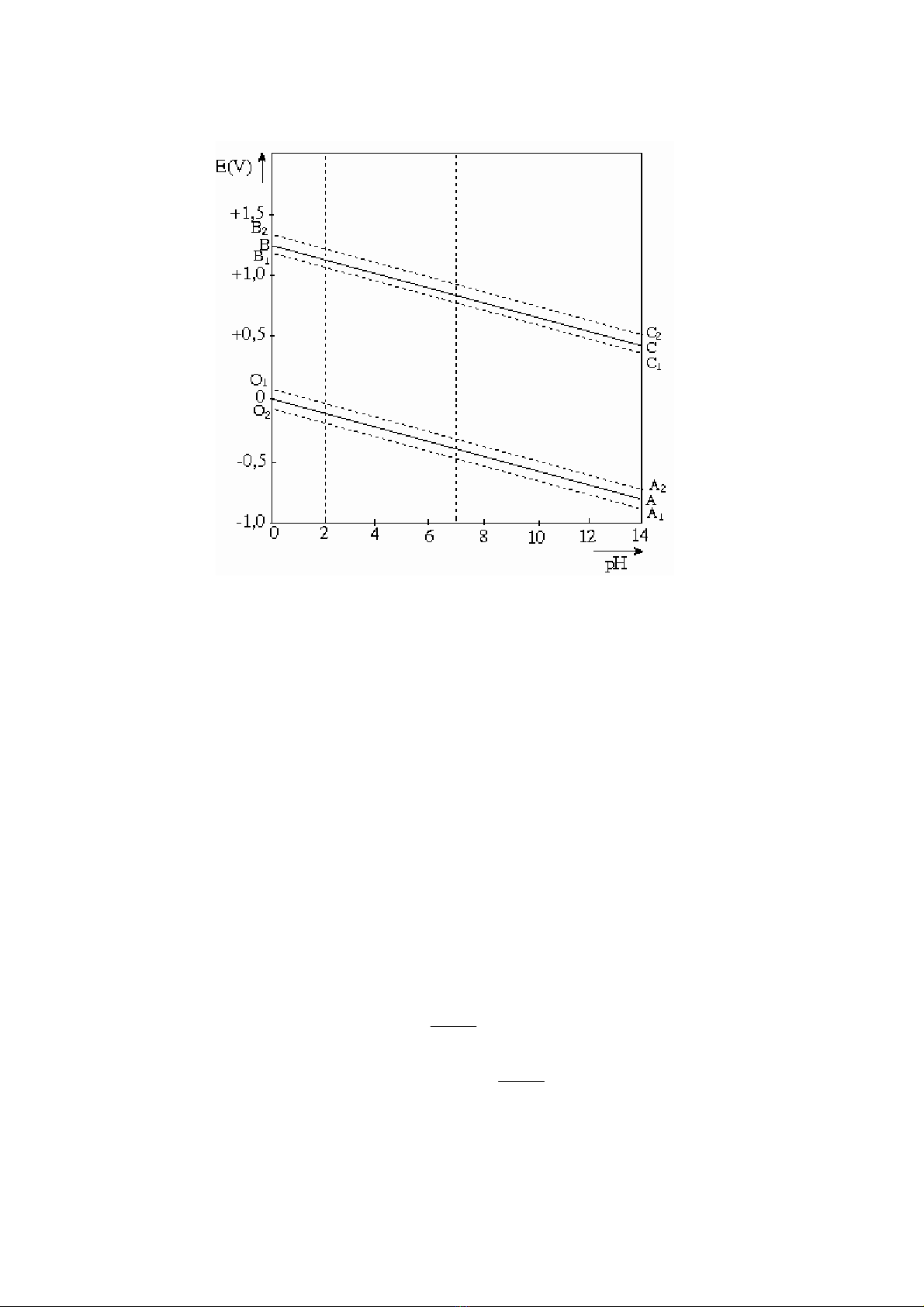
54
Hình 4.2
Giản đồ E - pH đối với hệ H2O, H+, OH−, O2 ở 25oC với 2
H
P = 1 atm, 2
O
P= 1atm
Khi 2
H
P > 1 atm đoạn thẳng OA dịch chuyển về phía âm ứng với O1A1 và sự khử ion H+
chiếm ưu thế, phản ứng dịch chuyển về phía phải. Ngược lại, khi 2
H
P< 1 thì đoạn OA dịch
chuyển về phía dương ứng với đoạn thẳng O2A2, khả năng giải phóng H2 bị hạn chế, nước ở
trạng thái bền vững.
Sự có mặt của oxi đóng vai trò rất quan trọng trong ăn mòn kim loại ở môi trường trung
tính. Trong trường hợp này sự hoà tan của kim loại thép xảy ra trên anot luôn gắn liền với
phản ứng catot - sự tiêu thụ oxi theo phản ứng:
O
2 + 4e + 4H+ U 2H2O (4.14)
hoặc O2 + 4e + 2H2O U 4OH− (4.15)
Phản ứng (4.14) xảy ra trên điện cực oxi, thế điện cực được tính theo phương trình Nernst
và có giá trị sau:
Ở 25oC: 22
O/HO
E = 22
o
O/HO
E + 0,059
4lg 4
H
a
+
.2
O
P (4.16)
hoặc: 22
O/HO
E = 1,228 V – 0,059pH + 0,059
4lg 2
O
P (4.17)
Khi 2
O
P= 1 atm, sự phụ thuộc của thế điện cực vào pH theo (4.17) được thể hiện trên
hình 4.2 ứng với đoạn thẳng BC.



![Đề cương môn học Chuyển đổi Nhiệt động lực học [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2020/20200302/covid19/135x160/7991583168321.jpg)







![Chương trình đào tạo cơ bản Năng lượng điện mặt trời mái nhà [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260126/cristianoronaldo02/135x160/21211769418986.jpg)

![Chương trình đào tạo cơ bản Năng lượng gió [Tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260126/cristianoronaldo02/135x160/53881769418987.jpg)












