anion nhãm I: Cl-, Br-, I-, SCN-, S2O32-
Môc tiªu
1. ViÕt ®−îc ph¶n øng cña thuèc thö nhãm víi c¸c anion nhãm I
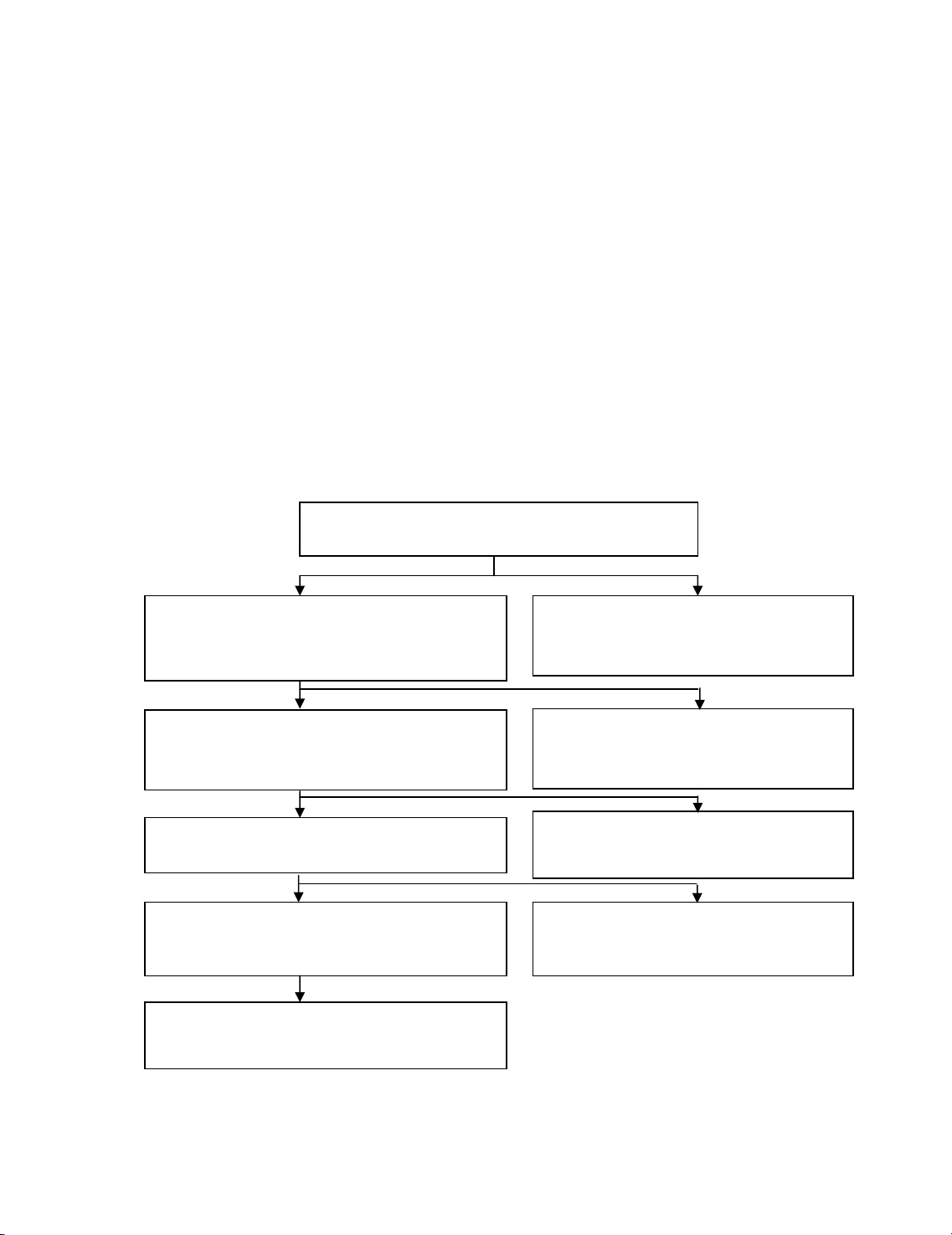
2. Gi¶i thÝch ®−îc c¸c b−íc ph©n tÝch theo s¬ ®å 6 ®Ó t¸ch riªng vµ t×m tõng anion
1. TÝnh chÊt chung
−
C¸c anion nhãm I t¹o kÕt tña víi Ag+ trong m«i tr−êng acid HNO3
lo·ng. Muèi b¹c cña c¸c anion nhãm nµy kh«ng tan trong acid HNO3.
V× thÕ AgNO3 + HNO3 ®−îc gäi lµ thuèc thö nhãm ®Ó t¸ch riªng anion
nhãm I ra khái hçn hîp ph©n tÝch. Sau ®ã dùa vµo c¸c ph¶n øng ®Æc
tr−ng cña tõng anion ®Ó t¸ch vµ ph¸t hiÖn chóng.
−
§Ó lo¹i c¸c cation g©y trë ng¹i khi x¸c ®Þnh c¸c anion, cÇn chuyÓn
dung dÞch ph©n tÝch thµnh n−íc soda (xem môc 4 Bµi 2). Ch¼ng h¹n,
trong n−íc soda th× Hg2+ ®−îc lo¹i bá, nhê ®ã c¸c anion Cl-, I- ®−îc gi¶i
phãng khái HgCl2, HgI+, HgI3- lµ nh÷ng hîp chÊt tan nhiÒu nh−ng
®iÖn ly rÊt kÐm
2. C¸c ph¶n øng ph©n tÝch ®Æc tr−ng cña anion nhãm I
2.1. Ph¶n øng cña Cl-
−
Víi Ag+:
Cl- + AgNO3 = AgCl ↓ tr¾ng + NO3-
AgCl tan trong NH4OH, KCN, Na2S2O3... ®Ó t¹o thµnh c¸c phøc tan.
−
Víi Pb2+
2Cl- + Pb2+ = PbCl 2↓ tr¾ng
PbCl2 tan trong n−íc nãng vµ kÕt tña trë l¹i khi lµm l¹nh.
−
Ph¶n øng oxy hãa:
2Cl- + PbO2 + 4H+ = Cl2 + Pb2+ + 2H2O
83