anion nhãm II: CO32-, PO43-, CH3COO-,
AsO33-, AsO43-, SO32-, SO42-, (S2O32-)
Môc tiªu
1. ViÕt ®−îc ph¶n øng cña thuèc thö nhãm vµ mét sè ph¶n øng ®Æc tr−ng cho c¸c
anion nhãm II.
2. Gi¶i thÝch ®−îc c¸c b−íc ph©n tÝch theo s¬ ®å 7 ®Ó t×m anion nhãm II.
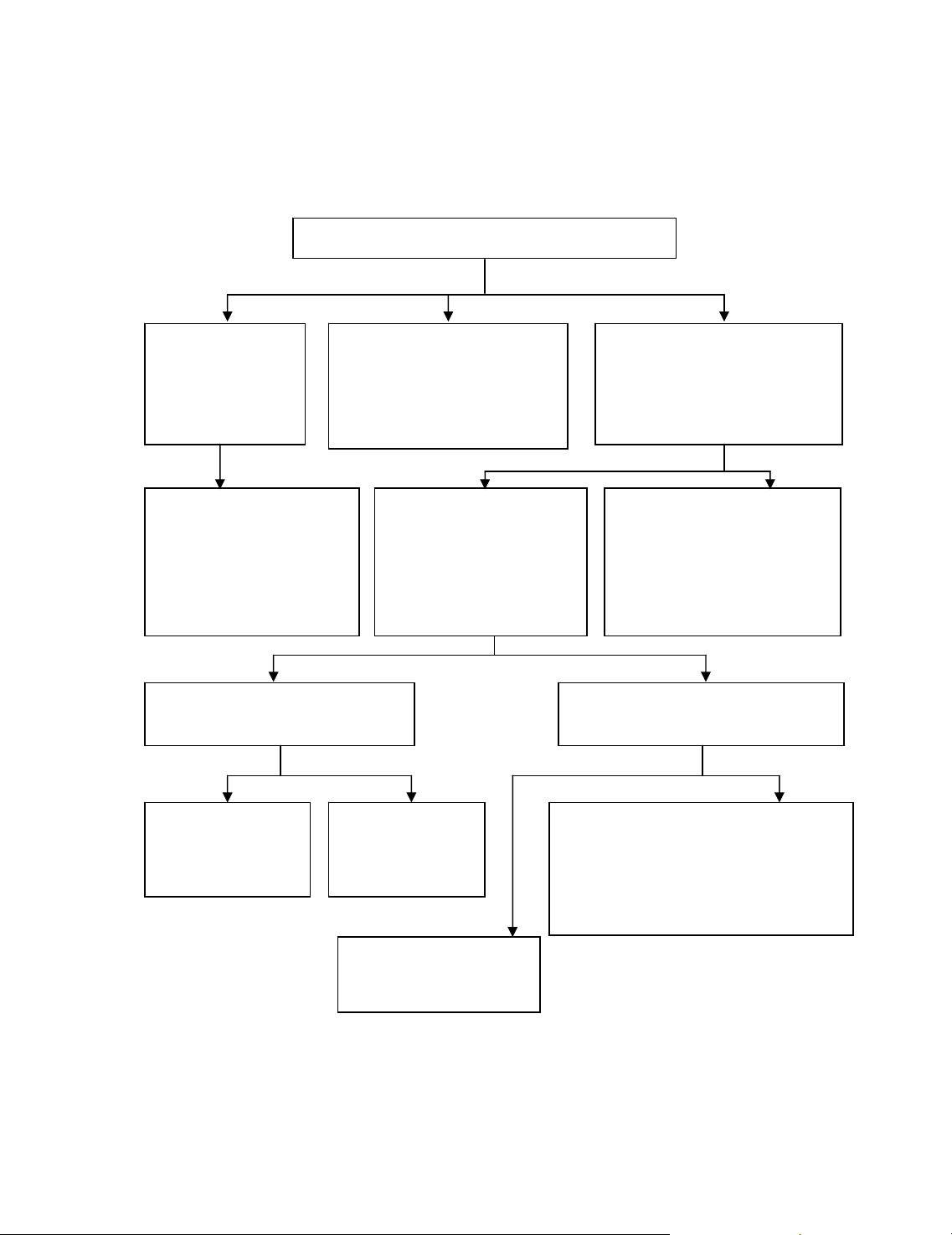
1. §−êng lèi ph©n tÝch nhãm II
−
Kh«ng cã thuèc thö nhãm chung cho tÊt c¶ c¸c anion nhãm II. §Ó ®Þnh
tÝnh anion nhãm nµy, cÇn sö dông nhiÒu ph−¬ng ph¸p ph©n tÝch vµ
thuèc thö kh¸c nhau, nh−:
+ Ph−¬ng ph¸p ph©n tÝch riªng biÖt ®Ó t×m trùc tiÕp mét ion tõ dung
dÞch gèc, vÝ dô ®èi víi CO32-, CH3COO-.
+ Ph−¬ng ph¸p ph©n tÝch nöa hÖ thèng ®Ó t×m vµi anion, vÝ dô ®èi víi
côm SO32-, SO42- vµ S2O32- .
+ Dïng thuèc thö nhãm, vÝ dô hçn hîp Mg ®Ó x¸c ®Þnh AsO43-, PO43-
+ Dïng thuèc thö ®Æc hiÖu, vÝ dô formalin ®Ó t×m SO32-; amoni
molypdat ®Ó t×m PO43-
−
§Ó lo¹i c¸c cation g©y rèi cho ph¶n øng ®Æc tr−ng hay ¶nh h−ëng ®Õn
ph¶n øng ®Æc hiÖu, cÇn chuyÓn dung dÞch ph©n tÝch thµnh n−íc soda
(xem môc 4, Bµi 2) tr−íc khi t×m anion.
2. C¸c ph¶n øng ®Æc tr−ng cña anion nhãm II
2.1. Ph¶n øng cña CO32-
−
Víi Ba2+:
Ba2+ + CO32- = BaCO3↓tr¾ng
BaCO3 tan trong acid v« c¬ th«ng th−êng.
88