
Ph©n tÝch tæng hîp c¸c nhãm cation theo
ph−¬ng ph¸p acid – base
Môc tiªu
1. T¸ch riªng ®−îc c¸c nhãm cation b»ng thuèc thö nhãm
2. X¸c ®Þnh ®−îc c¸c cation cã mÆt trong mçi nhãm b»ng c¸c s¬ ®å ph©n tÝch 1,2, 3,
4 ®· biÕt.
1. Dông cô – hãa chÊt – Thuèc thö
−
Nh− c¸c bµi 2, 3, 4, 5
−
Dung dÞch ph©n tÝch chøa cation c¸c nhãm
2. Thùc hµnh
2.1. TiÕn hµnh ph©n tÝch theo s¬ ®å 5 ®Ó t¸ch nhãm cation
2.2. Nhãm cation ®· t¸ch ®−îc ph©n tÝch theo s¬ ®å t−¬ng øng ë c¸c
bµi 2, 3, 4, 5 phÝa tr−íc ®Ó nhËn biÕt tõng ion cã mÆt.
118
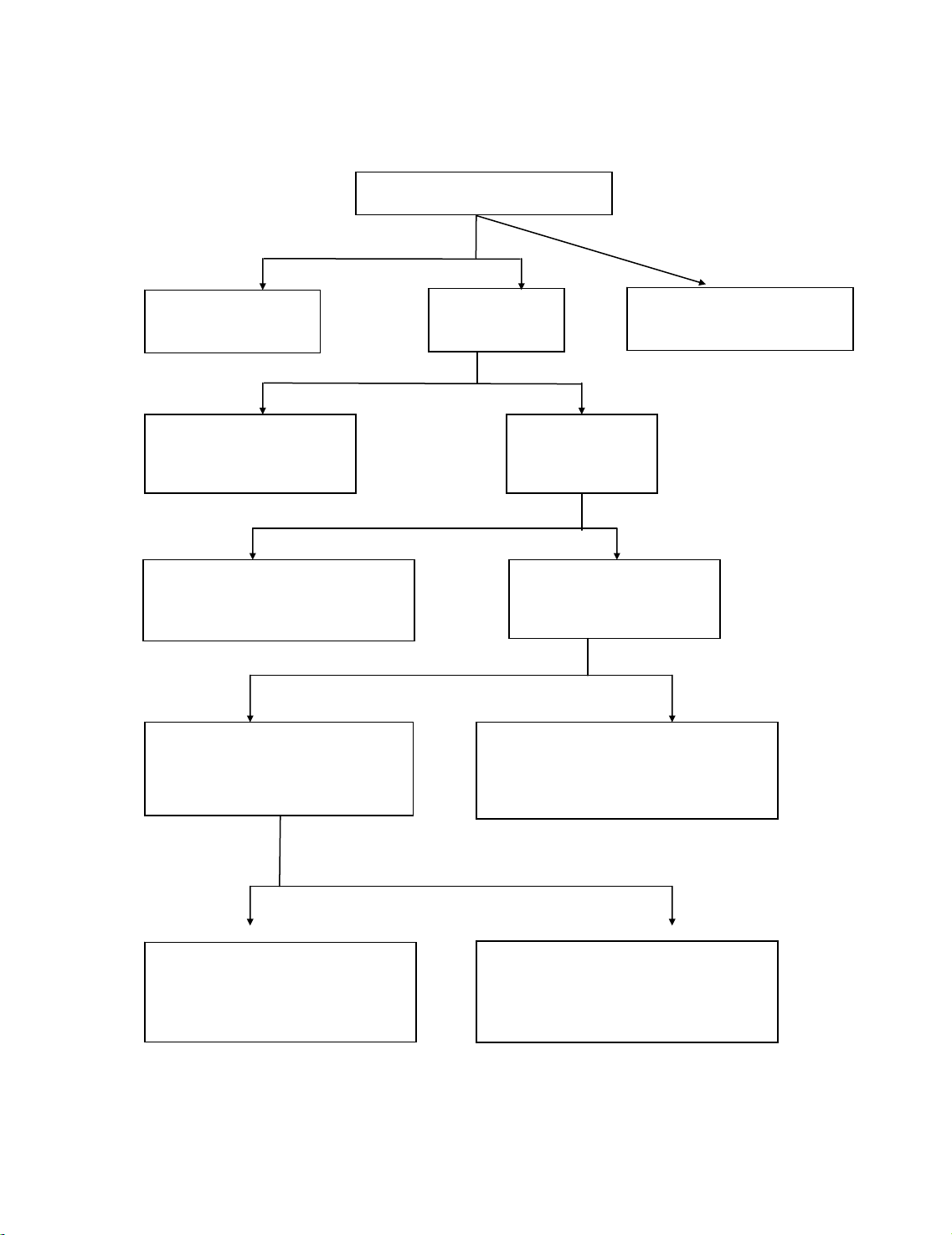
S¬ ®å 5: S¬ ®å thùc hµnh ph©n tÝch tæng hîp c¸c nhãm cation
Nhãm I: (tña clorid)
AgCl, Hg2Cl2, PbCl2
N−íc ly t©m
+ H2SO42N
(
Ph©n tÝch theo s¬ ®å 4
)
+ HCl 6N
Ly t©m
Nhãm II: (tña sulfat)
BaSO4, CaSO4, (SrSO4)
(
Ph©n tÝch theo s¬ ®å 1
)
L
y
t©m
Nhãm III:
(n−íc ly t©m chøa oxoanion)
AlO2−, ZnO22−, (SnO32−, CrO42−)
KÕt tña (oxyd, hydroxyd
nhãm (IV+V)
+HNO3 (+H2O2))
N−íc ly t©m
+ Na2CO3 tíi tho¸ng ®ôc
+ NH4OH ®Æc
(+ H2O2)
Tña HSbO3 (hoÆc Sb2O5.H2O)
Hoµ tan b»ng HCl ®Æc →X¸c ®Þnh Sb:
- Ph¶n øng thuû ph©n
- Thuèc thö Caile - Viel
L
y
t©m
L
y
t©m
L
y
t©m
(
Ph©n tÝch theo s¬ ®å 2
)
(
Ph©n tÝch theo s¬ ®å 2
)
(Sb3+,5+ cã thÓ xÕp nhãm IV do t¹o tña
hydroxyd/acid, kh«ng t¹o phøc
amoniacat/ hoÆc xÕp riªng)
N−íc ly t©m
+ NaOH 2N d−
(+H2O2)
Nhãm VI: (dung dÞch ph©n
tÝch): NH4+, Na+, K+
Dung dÞch ph©n tÝch cation
Nhãm V: (n−íc ly t©m chøa
amoniacat)
Cu(NH3)42+, Hg(NH3)42+
(Ni(NH3)42+, Co(NH3)42+, Cd(NH3)42+)
Nhãm IV: (tña hydroxyd)
Fe(OH)2, Fe(OH)3,
Bi(OH)3, MnO2, Mg(OH)2
(
Ph©n tÝch theo s¬ ®å 4
)
(
Ph©n tÝch theo s¬ ®å 3
)
119


























