
cation nhãm VI: Na+, K+, NH4+
Môc tiªu
1. ViÕt ®−îc c¸c ph¶n øng ®Æc tr−ng ®Ó t×m c¸c cation nhãm VI.
2. Gi¶i thÝch ®−îc c¸c b−íc ph©n tÝch theo s¬ ®å 4 (phÇn ph©n tÝch cation nhãm VI).
1. TÝnh chÊt chung
Muèi cña c¸c cation nhãm nµy ®Òu lµ muèi tan, nªn thuèc thö chung
cña nhãm kh«ng cã. Chóng ta t×m lÇn l−ît tõng ion trùc tiÕp tõ dung dÞch
ph©n tÝch (dung dÞch gèc) nhê vµo c¸c ph¶n øng ®Æc tr−ng cña tõng cation
víi tõng thuèc thö riªng.
2. C¸c ph¶n øng ph©n tÝch ®Æc tr−ng cña cation nhãm VI
2.1. T×m K+
2.1.1. B»ng thuèc thö Garola Na3[Co(NO2)6] ë m«i tr−êng trung tÝnh:
2K+ + Na+ + [Co(NO2)6]3-= K2Na[Co(NO2)6] ↓ tinh thÓ vµng
Nh−ng NH4+ còng cho ph¶n øng t−¬ng tù:
2NH4+ + Na+ + [Co(NO2)6]3-= (NH4)2Na[Co(NO2)6] ↓ tinh thÓ vµng
Do ®ã ph¶i lo¹i NH4+ b»ng kiÒm vµ ®un nãng, sau ®ã ®−a dung dÞch vÒ
pH gÇn trung tÝnh tr−íc khi thªm thuèc thö.
Ph¶n øng t×m K+ bÞ c¶n trë bëi ion I- vµ ®é nh¹y cña ph¶n øng t¨ng
lªn khi cã mÆt ion Ag+. NÕu cã I- ph¶i lo¹i tr−íc b»ng HNO3 ®Æc hoÆc H2O2
2.1.2. B»ng acid picric
K+ + C6H2(NO2)3OH = C6H4(NO2)3OK↓ vµng + H+
NH4+ + C6H2(NO2)3OH = C6H4(NO2)3ONH4↓ vµng + H+
CÇn lo¹i NH4+ b»ng kiÒm tr−íc khi t×m K+.
80

2.1.3. B»ng thö mµu ngän löa: K+ cho mµu tÝm.
2.2. T×m NH4+
2.2.1. B»ng kiÒm m¹nh
NH4+ + OH- = NH3↑ + H2O
NhËn biÕt NH3 bay lªn b»ng giÊy quú ®á tÈm −ít chuyÓn thµnh xanh,
hoÆc giÊy tÈm dung dÞch phenolphtalein chuyÓn thµnh ®á, hoÆc b»ng mïi
khai ®Æc tr−ng.
2.2.2. B»ng thuèc thö Nessler:
Trong thuèc thö Nessler NH4+ chuyÓn thµnh NH3 vµ cho ph¶n øng:
NH3 + 2K2[HgI4] + KOH = [HgI2NH2]I↓ n©u ®á + 5KI + H2O
TT Nessler Thuû ng©n(II)amidodiiodo iodid
Mét sè cation kim lo¹i chuyÓn tiÕp g©y c¶n trë ph¶n øng trªn do t¹o
tña hydroxyd cã mµu hoÆc ph¸ hñy thuèc thö, nªn ph¶i lo¹i chóng b»ng
kiÒm m¹nh vµ carbonat hoÆc khãa chóng trong phøc víi kali natri tartrat
(KNaC4H4O6) tr−íc khi dïng thuèc thö Nessler.
2.3. T×m Na+
2.3.1. B»ng thuèc thö Streng (KÏm Uranyl acetat)
Na+ + Zn(UO2)3(CH3COO)8 + CH3COO- = NaZn(UO2)3(CH3COO)9↓ vµng lôc
TT Streng
NaZn(UO2)3(CH3COO)9 cã tinh thÓ h×nh mÆt nhÉn khi soi trªn kÝnh
hiÓn vi.
C¸c ion Ag+, Hg22+, Sb3+ còng t¹o kÕt tña víi thuèc thö, nh−ng tinh thÓ
h×nh kim dµi; hoÆc lo¹i bá c¸c ion nµy b»ng kiÒm m¹nh tr−íc, råi míi dïng
thuèc thö Streng.
2.3.2. Thö mµu ngän löa:
Na+ cho mµu vµng ®Æc tr−ng.
3. S¬ ®å ph©n tÝch
81
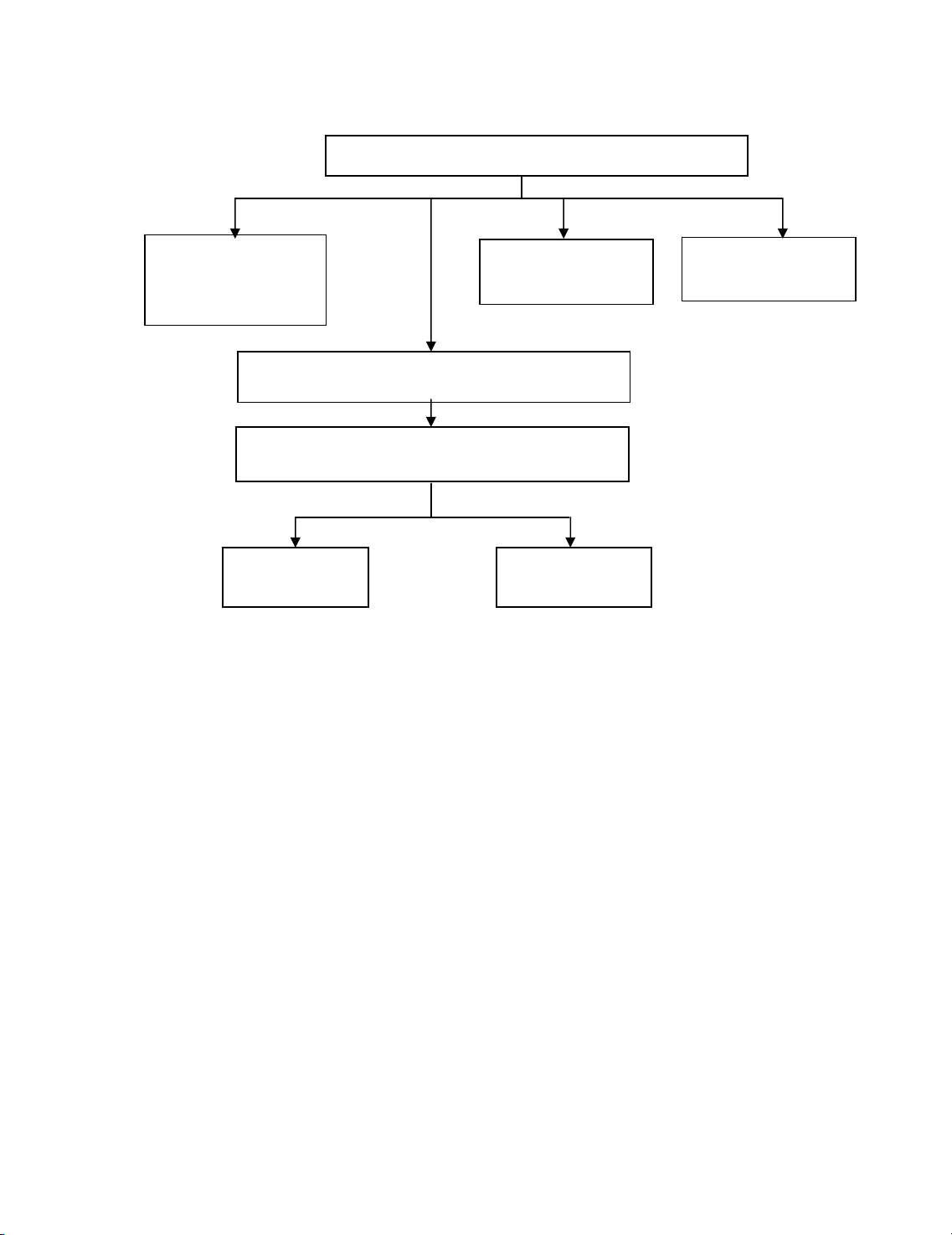
S¬ ®å 4*: S¬ ®å lý thuyÕt ph©n tÝch cation nhãm V: Hg2+, Cu2+ vµ nhãm VI: NH4+, Na+, K+
t T×m NH4+:
− B»ng NaOH ®Æc
− B»ng TT Nessler
Dung dÞch ph©n tÝch + Na2S. §un nãng
Tña ®en: CuS, HgS + HNO3. §un nãng
t T×m Na+:
B»ng TT Streng
t T×m K+:
B»ng TT Garola
N−íc l
y
t©m
t T×m Cu2+
Tña: H
g
S + S
t T×m Hg2+
Dung dÞch ph©n tÝch: Hg2+, Cu2+, NH4+, Na+, K+
* S¬ ®å thùc hµnh t−¬ng øng: xem s¬ ®å 4, PhÇn2. Thùc hµnh ph©n
tÝch ®Þnh tÝnh
bµi tËp (bµi 8)
8.1. H·y hoµn thµnh c¸c ph−¬ng tr×nh ph¶n øng sau:
1) NaCl + Zn(UO2)3(CH3COO)8 + CH3COOH → ... +....
2) KCl + Na3[Co(NO2)6] → ... +....
3) NH4Cl + Hg(NO3)2 + KId− → ... +....
4) KCl + C6H4(NO2)3OH → ... +....
8.2. H·y gi¶i thÝch v× sao cÇn cho dung dÞch kali natri tartrat ®Æc
tr−íc khi cho thuèc thö Nessler vµo dung dÞch gèc ®Ó nhËn biÕt
ion NH4+?
8.3. Cã thÓ cho dung dÞch K2CO3 b·o hßa vµ NaOH ®Æc vµo dung dÞch
gèc tr−íc khi nhËn biÕt ion Na+ b»ng thuèc thö Streng? V× sao?
8.4. Cã thÓ cho dung dÞch Na2CO3 b·o hßa vµ KOH ®Æc vµo dung dÞch
gèc tr−íc khi nhËn biÕt ion K+ b»ng thuèc thö Garola? V× sao?
82


























