
TS Ngô Gia Lương

Khái niệm về acid, base
Khái niệm về acid, base.
.
a.
a. Thuyết cổ điển của Arrhenius
Thuyết cổ điển của Arrhenius
b. Thuyết proton Bronsted
b. Thuyết proton Bronsted
Thuyết cổ điển của Arrhenius
Thuyết cổ điển của Arrhenius
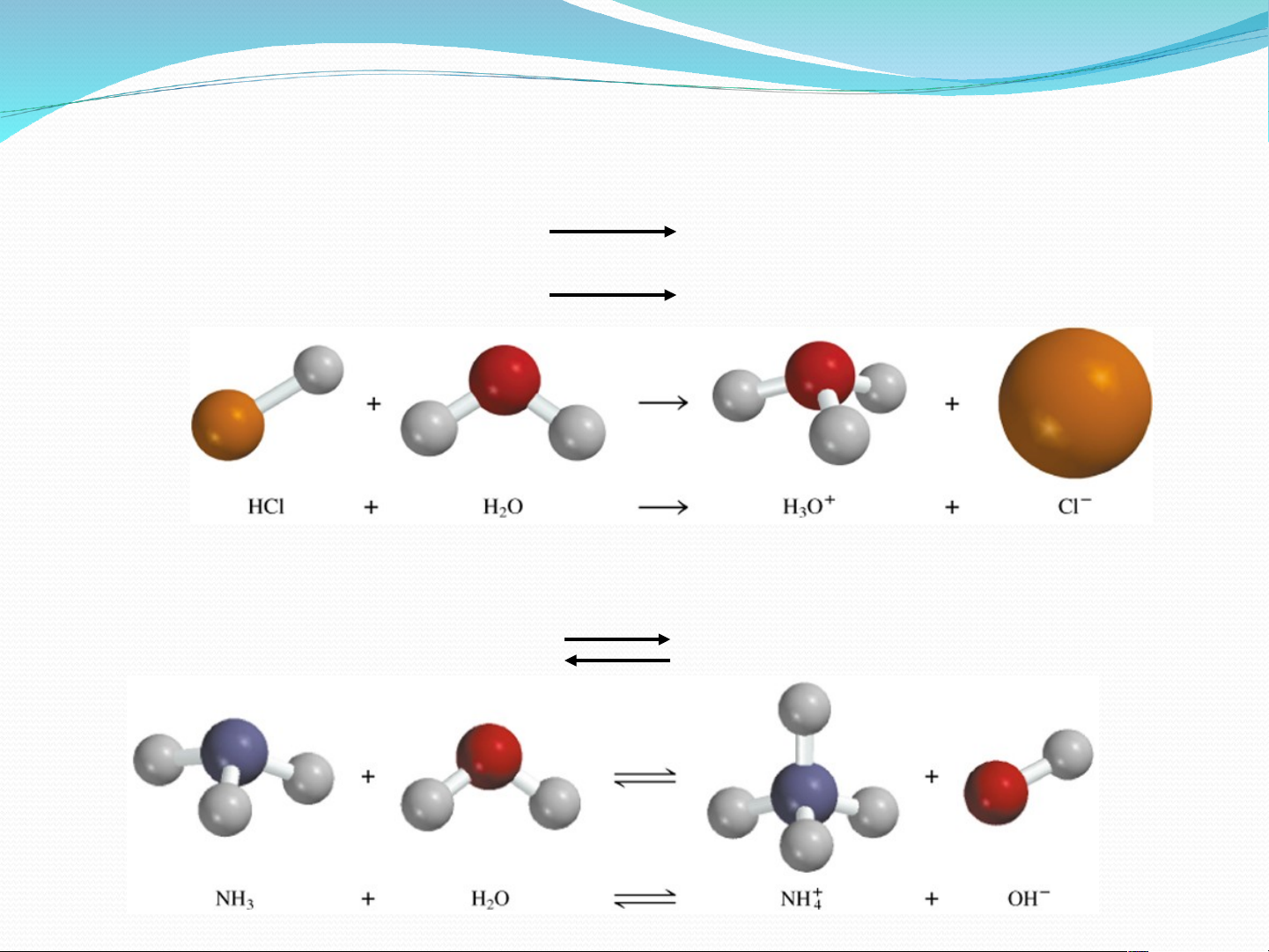
Acid Arrhenius: chất điện ly cho ion H3O+ trong nước
Base Arrhenius: chất điện ly cho ion OH- trong nước
HCl(aq) +H2O(l) H3O+(aq) + Cl-(aq)
HNO3(aq)+H2O(l) H3O+(aq) + NO3
-(aq)
NH3(aq) + H2O (l) NH4
+(aq) + OH-(aq)

Thuyết proton Bronsted
Thuyết proton Bronsted
Acid Bronsted : cho proton H+HA H+ + A-
Base Bronsted : nhận proton H+ B + H+ BH+
Các cặp acid–base liên hợp: HA
HA/
/A
A-
- ,BH+/B
HA
HA + B A
A-
- + BH+
Phản ứng giữa acid
acid và base là pư trao đổi
proton(H+) giữa acid
acid của 1cặp acid
acid-
- base
base liên hợp
này với 1 base của 1 cặp acid-base liên hợp khác.

Phản ứng giữa các cặp acid base liên hợp
Phản ứng giữa các cặp acid base liên hợp
Acid + Base Base + Acid
C p liên h pặ ợ
C p liên h pặ ợ
Reaction 1 HF + H2O F– + H3O+
Reaction 2 HCOOH + CN– HCOO– + HCN
Reaction 3 NH4
+ + CO3
2– NH3 + HCO3
–
Reaction 4 H2PO4
– + OH– HPO4
2– + H2O
Reaction 5 H2SO4 + N2H5
+ HSO4
– + N2H6
2+
Reaction 6 HPO4
2– + SO3
2– PO4
3– + HSO3
–

![Bài giảng Thực hành nghiên cứu khoa học Cao đẳng Điều dưỡng [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260123/lionelmessi01/135x160/84711769186058.jpg)

![Bài giảng Vitamin và khoáng chất [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240910/gaupanda051/135x160/1877587698.jpg)



![Bài giảng Rối loạn chuyển hóa Lipid và các nguy cơ tim mạch [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2019/20190813/lequangvinh1608/135x160/656432194.jpg)


















