
1
1
CÂN BẰNG PHA HỆ 1 CẤU TỬ
5.1. Khái quát về cân bằng pha trong hệ một cấu tử
5.2. Phương trình Clausius - Clapeyron
5.3. nh hưng của áp suất tổng đến áp suất hơi
bão hòa
5.4. nh hưng của nhiệt độ đến áp suất hơi bão
hòa
5.5 Biểu đồ trạng thái của hệ một cấu tử
CHƯƠNG 5
2
5.1. Khái quát về cân bằng pha
trong hệ một cấu tử
Hêmtcutưl hê ch gmmtcht nguyên cht. Cân
bng pha trong hêmtcutưl cân bng giacctrng
thitphpcamtcht. trng thi khihoclng,hu
htccchtch tntich c mtdng pha. Song chng c
nhiutrng thitphprnkhc nhau gil ccdng đa
hnh hay điviđơn chtgil ccdng thù hnh.
Sư chuyntư trng thitphpny sang trng thitp
hpkhcgil sư chuynpha cahêmtcutư.Sư
chuyn pha bao giơ cng km theo sưthay điđtngt
nhng tnh chtcahênhư khilưng riêng, nhitdung,
thêtch,hiung nhit…
Khi pdng quy tcpha Gibbs cho hêmtcutưta c:
f32f12fkc
3
Nếuhêgồm 1 pha:c = 2. Nghal ca2 thông sôbên ngoi
đuc thêtythay đi trong mtgiihnxcđnh m hê
vntnti 1 pha.
Nếuhêgồm 2 pha nằmcân bằng:c = 1.Nghal trong 2
thông sôbên ngoi, thi ch mt thông sôl đclp, thông sô
cnlil thông sôphu thuc. Nicch khc, mipsut,
nhitđô chuyn pha c giatr phu thucva xcđnh.Ngưc
li, cng c thênipsutchuynpha l hm sô canhitđô
chuynpha.
Nếuhêgồm 3 pha nằmcân bằng:c = 0.nghal ch c thê
tnti cân bng ca 3 pha trong mtđiukinbên ngoihon
tonxcđnh (vê psutva nhitđô). Cng c thê khng
đnh, tuy hêmtcutư c thêtnti nhiudng pha khc
nhau, song sôpha đng thinm trong mttrng thi cân
bng tiđa ch c thêl 3(v đôtưdo c≥0).
5.1. Khái quát về cân bằng pha
trong hệ một cấu tử
4
5.2.1 nh hưng của áp suất đến nhiệt độ
chuyển pha
Đivihêmtcutưthithêđng pch cnphuthuc
vonhit đ và áp sut nên ccđilưng đctrưng cơ
bn cho sư chuynpha l nhit đ và áp sut.Chng c
mi liên hê trctipvinhau trong qu trnh chuynpha
đa đưc Clapeyron - Clausius thitlpbng biuthc:
Trong đo:
T: nhitđô tuytđi.
V: sư bin thiên thêtch capha tothnh va
pha ban đu.
: nhitchuynpha.
V.T
dP
dT
5.2. Phương trình Clausius Clapeyron
2
5
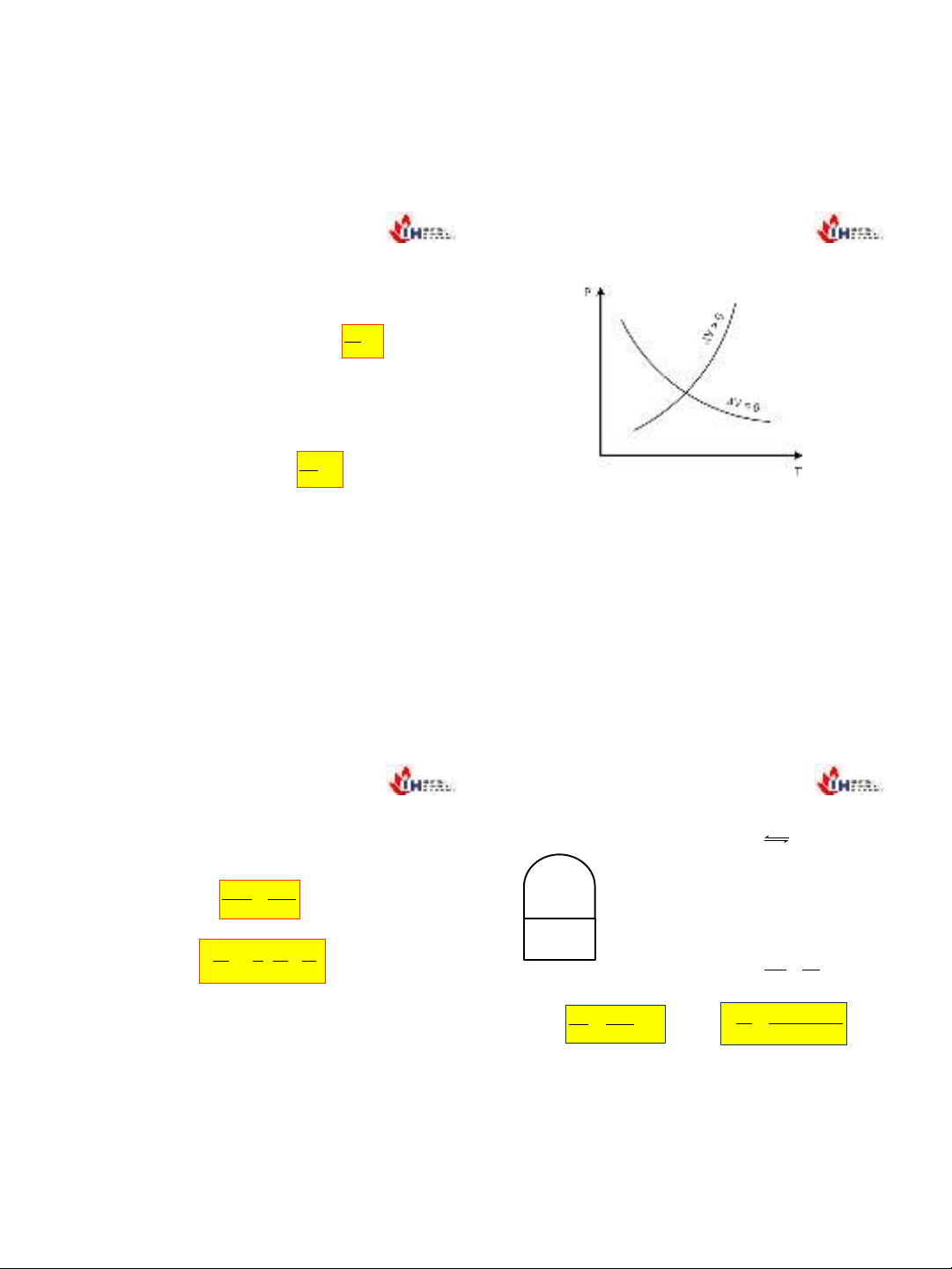
Ta co nhnxtsau:
Viqu trnh sôi (hóa hơi):
λhh>0 và ΔV =Vh–Vl>0 nên:
Viqu trnh nng chythicnVcothê dương hoc
âm.đa sô chtthido đo:
0
dP
dT
Nghal khi psuttăng thi nhitđô tăng.Đưng cong P =
f(T) hưng sang phi (hình 5.1). Đây là trưng hp ph
bin ca nhiu nguyên cht.
0
dP
dT
5.2.1 nh hưng của áp suất đến nhiệt độ
chuyển pha
5.2. Phương trình Clausius Clapeyron
6
Hình 5.1. Sự phụ thuộc của nhiệt độ nóng chảy vào
áp suất
5.2.1 nh hưng của áp suất đến nhiệt độ
chuyển pha
7
Phương trnh Clausius - Clapeyron II mô t nh hưng
ca nhit đ đn áp sut hơi bão hòa:
Ta có th rút ra:
Từ phương trình này ta có th tính toán gn đng các
thông s nhit đng như áp sut hơi,nhit đ sôi hay
nhit hóa hơi…
2
RT
dT
dlnP
121
2
T
1
T
1
RP
P
ln
5.2.2 nh hưng nhiệtđôđếnpsuấthơi
bohòa
5.2. Phương trình Clausius Clapeyron
8
Khi h cân bng: Glng Ghơi
Hay dGl=dGh
Khi T = const: dG = V. dP
Nên ta có: Vl.dPl= Vh.dPh
Áp suttcđng lên pha lng chnh l p
suttng cng nên:
5.3. nh hưng của áp suất tổng
cộng đến áp suất hơi bão hòa
Lỏng A
Hơi A + khí
Pt= P + P’
Xét hệ sau:
h
l
tV
V
dP
dP
t
1dP
R.T
V
P
dP
T.R
PPV
P
P
ln 1,t2,tl
1
2
Ta chng minh đưc h thc sau:
hay
3
9
Theo Clausius Clapeyron thì nhit chuyn pha tùy thuc vào
áp sut cân bng nên =(T, P)
Ly vi phân từng bin và kt hp PT C–C I ta có:
+Đi vi cân bng L–Hhay R–H, ta có:
+Đi vi cân bng R–L, ta có:
5.4. nh hưng của nhiệt độ đến
nhiệt chuyển pha
P
PT
ΔVln
λ
T
λ
ΔC
dT
dλ
P
ΔC
dT
dλ
T
λ
ΔC
dT
dλ
P
10
Trng thái ca h mt cu tử có th biu diễn bi phương trình
liên h gia các thông s ca h.
Nhưng các h ta thưng gp không ch là h mt pha khí lý
tưng mà là h d th nhiu pha.Nu dùng phương trình trng
thái đ biu diễn mt h như th thì rt phc tp.Do đ ngưi
ta thưng biu diễn trng thái ca h bng các gin đ.
Trng thái ca h đưc hoàn toàn xác đnh bi ba thông s:áp
sut,nhit đ và th tích riêng. Vì th biu đ không gian gm
ba trc thng góc vi nhau, trên đ ghi tương ng các giá tr P,
Tvà V. Nu kho sát trong điu kin 1 thông s nào đ ca h
không đi thì ta có các biu đ phng:
–Khi V = const, ta có biu đ đng tích (P -T).
–Khi P = const, ta có biu đ đng áp (T -V).
–Khi T = const, ta có biu đ đng nhit (P -V).
Tùy theo yêu cu nghiên cu mà ta sử dng nhng biu đ
thích hp. Sau đây chúng ta xét biu đ trng thái (P -T) ca
vài cht đ làm ví d.
5.5. Giản đồ trạng thái của hệ một cấu tử
11
5.5. Giản đồ trạng thái của hệ một cấu tử
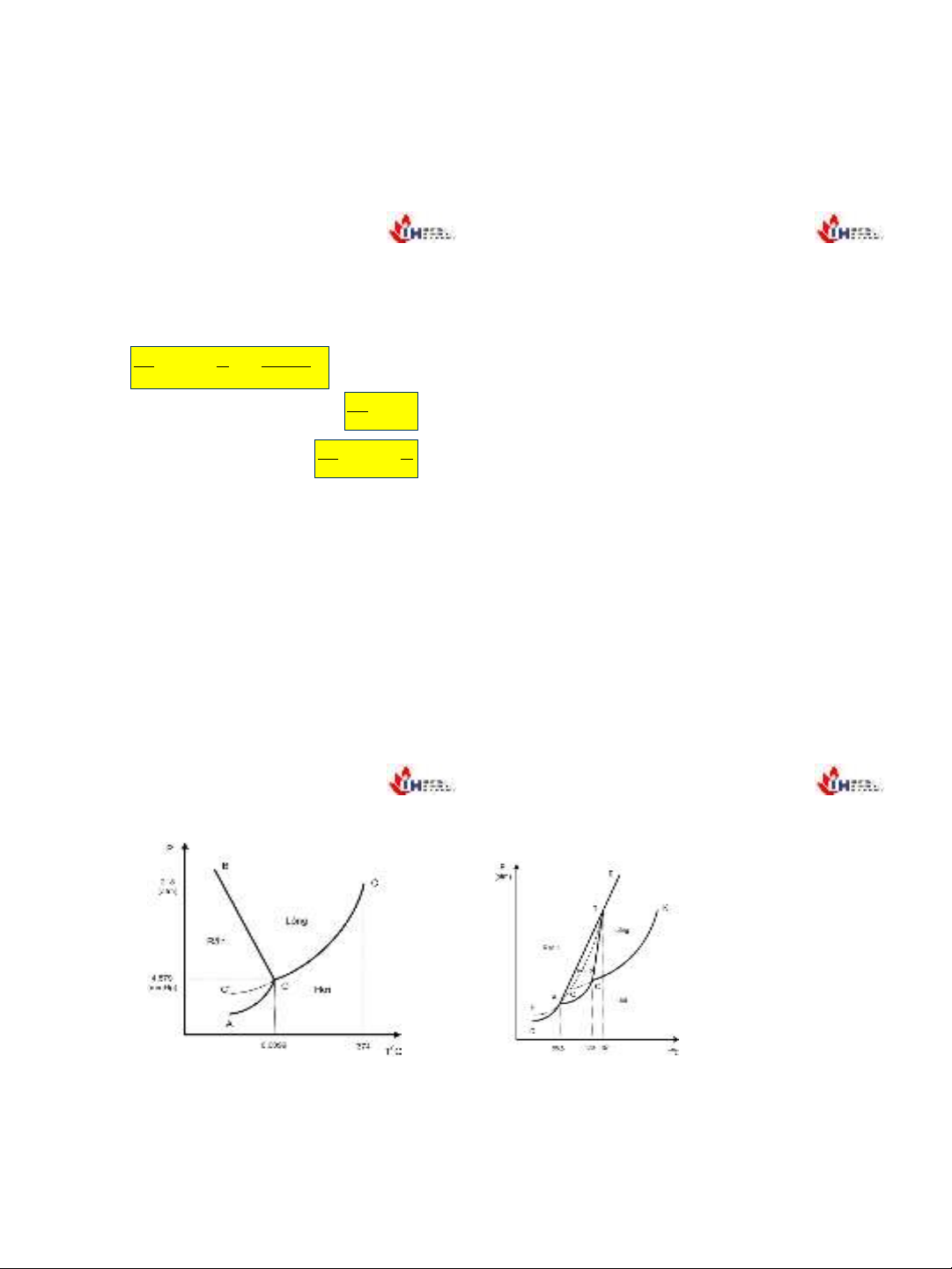
5.5.1 Biểu đồ trạng thái của nước
12
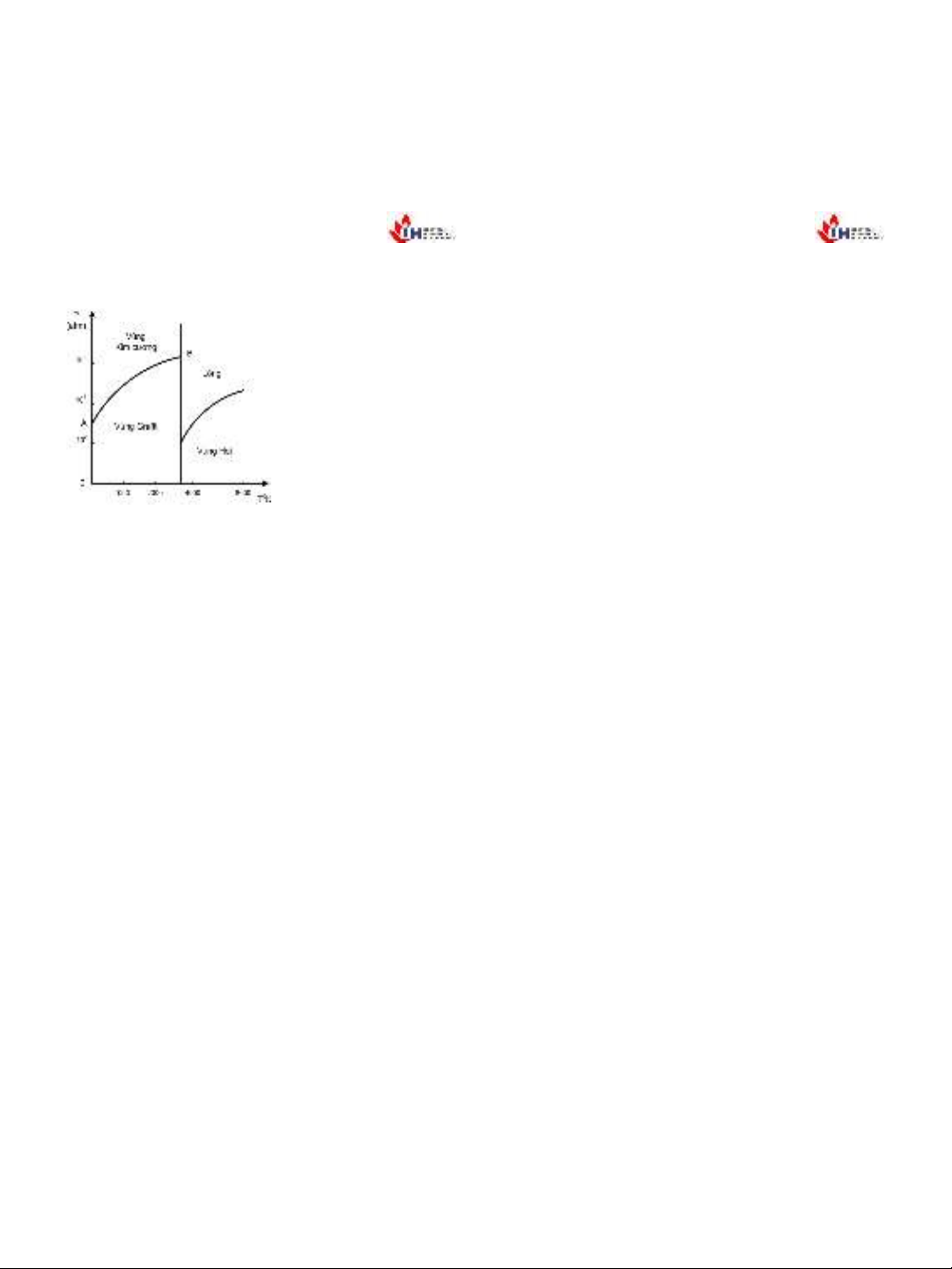
•Lưu huỳnh rắn tồn tại dưới hai dạng thù
hình là:dạng trực thoi (dạng rombic: R.1) và
dạng đơn tà (monoclinic: R.2).
•Các đường nét liền trên giản đồ mô tả cân
bằng bền giữa hai pha tương ứng.Những
đường này chia giản đồ thành 4 vùng tương
ứng với 4dạng pha. Điểm Kgọi là điểm tới
hạn.
•Các đường nét đứt mô tả các cân bằng
không bền.
Các điểm A, B và C là các điểm ba bền, mô tả
các cân bằng ba pha tương ứng.
5.5. Giản đồ trạng thái của hệ một cấu tử
5.5.2 Biểu đồ trạng thái củalưu huỳnh
4
13
Đường cong AB là đường cân bằng
cacbon dạng kim cương và cacbon dạng
grafit. Về mặt nhiệt động,ở điều kiện bình
thường grafit bền hơn kim cương.Muốn
chuyển hóa grafit thành kim cương ở
2980K thì phải cần áp suất P > 2,2.104atm.
Nhưng trong quá trình thực tế chỉ xảy ra
ở điều kiện nhiệt độ cao, áp suất rất cao và
có xúc tác. Ví dụ ở nhiệt độ 20000C, áp
suất trên 7,1.105atm và có hỗn hợp xúc tác
tantan - coban, người ta có thể tạo được
kim cương từ grafit.
5.5. Giản đồ trạng thái của hệ một cấu tử
5.5.1 Biểu đồ trạng thái của cacbon
14
Bài tp mẫu
Ví dụ 1: Tính áp sut cn thit đ nhit đ sôi ca nưc là
120,90C. Bit nhit hóa hơi ca nưc 538,1 cal/g.
Ví dụ 2: 00Cnhit nóng chy ca nưc đ là 5996,63 J/mol,
th tích riêng ca nưc lng và nưc đ tương ng là Vl=
1,001 cm3/g, Vr= 1,089 cm3/g.Hi khi áp sut 3 atm thì nhit đ
nóng chy ca nưc đ là bao nhiêu?
Ví dụ 4: Xác đnh lưng CS2đưc ly ra khi thi 0,005 m3
không khí vào CS2áp sut 720 mmHg và 400C. Cho bit nhit
hóa hơi ca CS2 nhit đ sôi chuẩn 46,50Clà 355,8 J/g.





![Bài giảng Truyền nhiệt [năm] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2017/20170821/kloiroong10/135x160/4471503277987.jpg)
![Bài giảng Khí lý tưởng Lê Quang Nguyên [PDF]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20160115/doinhugiobay_11/135x160/3731452833386.jpg)



![Động lực học chất lỏng lý tưởng: Chương 4 [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20150907/minhnhut1411995/135x160/1773168_156.jpg)
![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














