
Bài 22,Ti t 31 ế
C U TRÚC PHÂN T Ấ Ử
H P CH T H U CỢ Ấ Ữ Ơ
N I DUNG CHÍNHỘ
Luy n t p, c ng cệ ậ ủ ố
Liên k t hoá h c và c u trúc phân t h p ch t h u cế ọ ấ ử ợ ấ ữ ơ
Đ ng đ ng, đ ng phânồ ẳ ồ
Thuy t c u t o hoá h cế ấ ạ ọ
Công th c c u t oứ ấ ạ
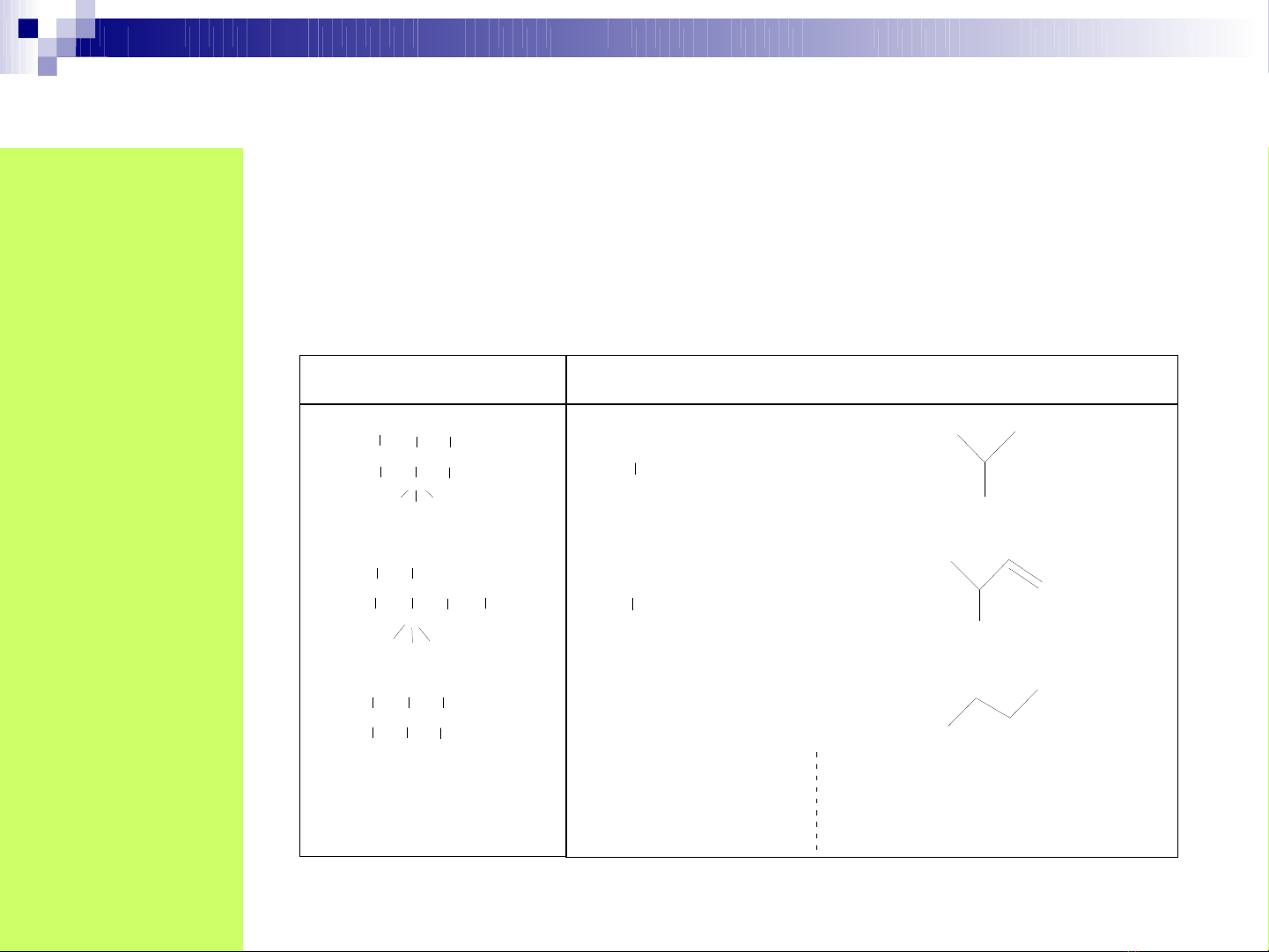
1. Khái ni mệ
Công th c c u t o bi u di n th t và cách th c liên k t (liên k t ứ ấ ạ ể ễ ứ ự ứ ế ế
đ n, liên k t b i) c a các nguyên t trong phân t .ơ ế ộ ủ ử ử
2. Các lo i công th c c u t oạ ứ ấ ạ
CTCT khai trieån CTCT thu goïn
- C - C - C - H
- C - C - C - O - H
- C - C - C = C - H
H
H
H
H
H
H
H
H
H H H
H
H
C
H
H
H
C
HHHH
HH H
HH
Bieåu dieãn treân maët
phaúng giaáy taát caû caùc
lieân keát
CH - CH - CH
CH - CH - CH = CH
CH
CH - CH - CH OH OH
3
3
3
3
3
22
2
CH
3
hoaëc
hoaëc
hoaëc
Caùc ng töû vaø nhoùm ng töû
cuøng lk vôùi ng töû C gom
thaønh 1 nhoùm
Chæ bieåu dieãn lk giöõa caùc ng töû C vaø vôùi nhoùm chöùc.
moãi ñaàu ñoaïn hoaëc ñieåm gaáp khuùc laø 1 ng töû C,
khoâng bieåu thò H lk vôùi C.
I. Công th c ứ
c u t oấ ạ
1. Khái ni mệ
2. Các lo i ạ
CTCT
Áp d ngụ
CH3CH2CH2-OH
CTCT
Khai tri n ?ể
CH3COOH
CH3COOCH3
I. Công th c ứ
c u t oấ ạ
1. N i dungộ
2. Các lo i ạ
CTCT
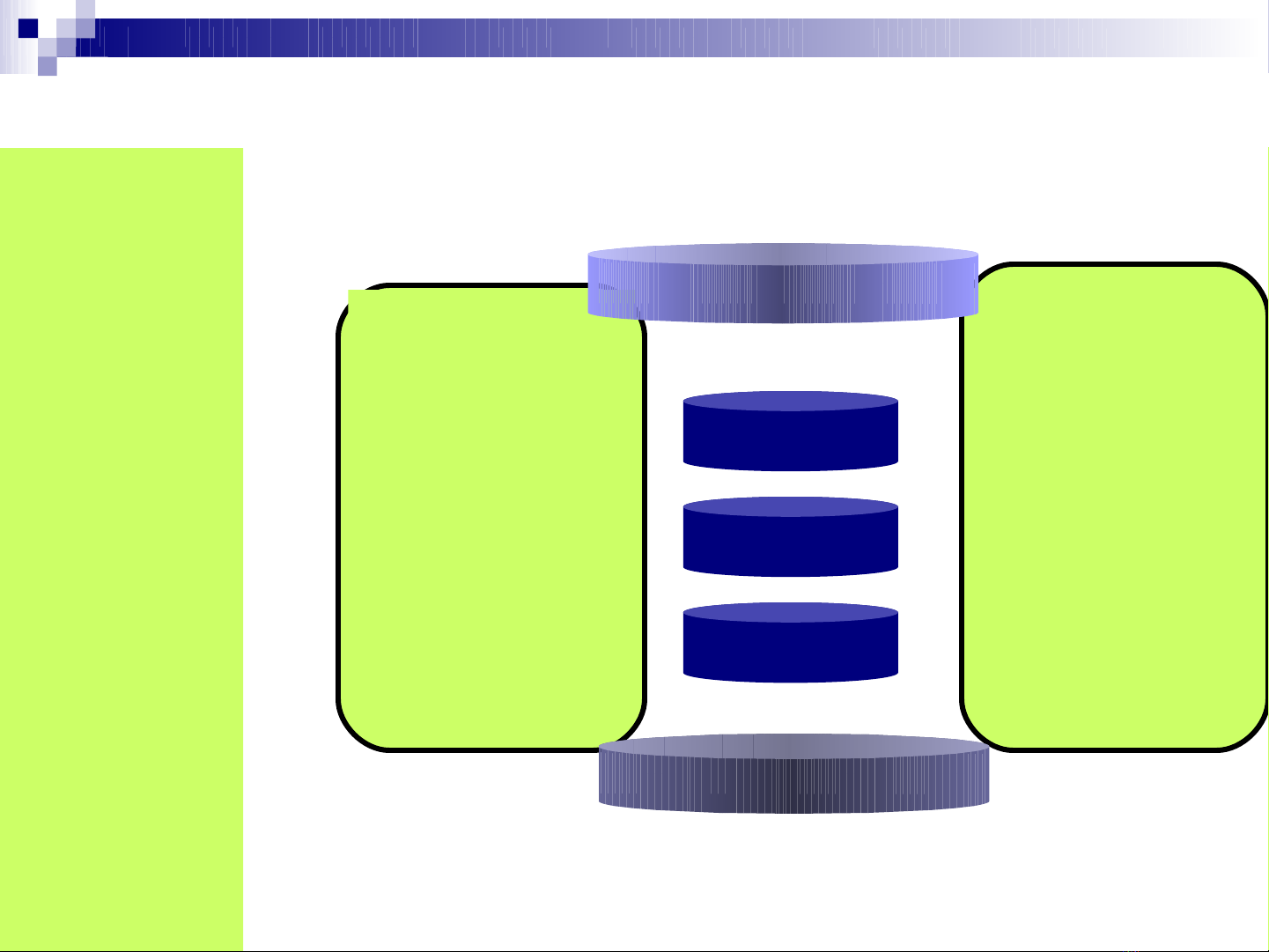
Đúng hoá trị
Theo tr t tậ ự
C u t o hoá h cấ ạ ọ
Trong phân t ử
HCHC, các nguyên
t liên k t v i nhau ử ế ớ
theo đúng hoá tr và ị
theo m t tr t t nh t ộ ậ ự ấ
đ nh. Th t liên k t ị ứ ự ế
đó g i là c u t o ọ ấ ạ
hoá h c. S thay đ i ọ ự ổ
th t liên k t đó t c ứ ự ế ứ
là thay đ i c u t o ổ ấ ạ
hoá h c, s t o ra ọ ẽ ạ
h p ch t khácợ ấ
Ví d :ụ
H p ch t h u c có ợ ấ ữ ơ
CTPT là C2H6O có
th là:ể
N i dung 1ộ
T m t CTPT có th có nhi u CTCTừ ộ ể ề
Ancol
etylic
CH3CH2O
H
ts=78,3oC
Đimetyl
ete
CH3OCH3
ts= -23oC
I. Công th c ứ
c u t oấ ạ
1. N i dungộ
2. Các lo i ạ
CTCT
II. Thuy t c u ế ấ
t o hóa h cạ ọ
1. N i dung 1ộ


























