
CHÖÔNG 6 –ÑIEÄN HOÙA HOÏC
I.PHAÛN ÖÙNG OXI HOÙA - KHÖÛ
Laø phaûn öùng coù söï thay ñoåi soá oxi hoùa cuûa caùc
nguyeân toá
Coù söï trao ñoåi e
Goàm hai quaù trình:
Chaát khöû 1 oxihoùa 1
Chaát oxihoùa 2 khöû 2
- e-
+ e-
QT oxi hoùa
QT khöû
Chaát khöû 1 + chaát oxi hoùa 2 oxi hoùa 1 + chaát khöû 2
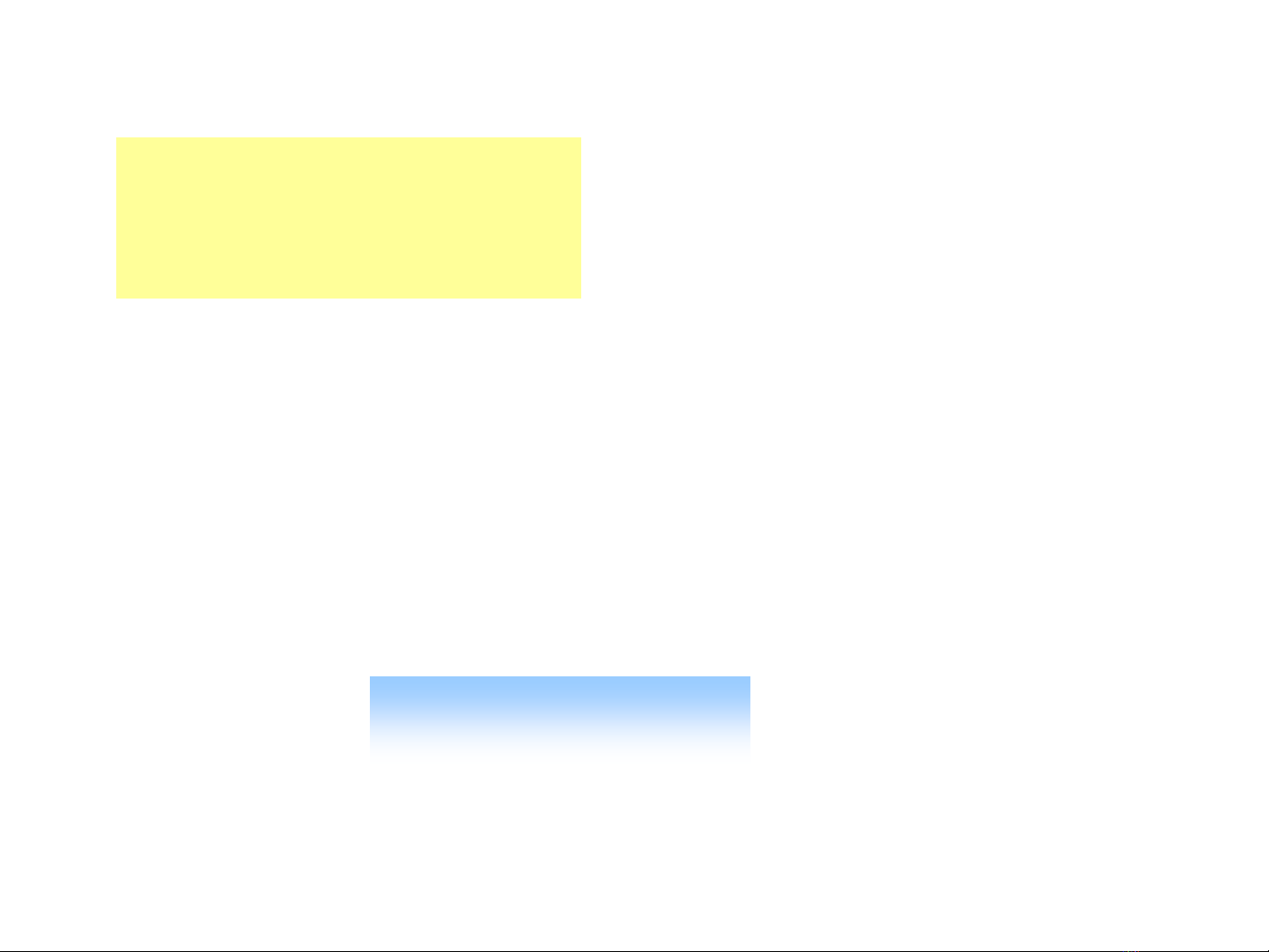
Ví duï: Zn + CuSO4ZnSO4+ Cu
00
+2 +2
Zn0-2 e Zn2+
Cu2+ + 2e Cu0
Zn daïng khöû / Zn2+ daïng oxi hoùa
Cu2+ daïng oxi hoùa/ Cu daïng khöû
Caân baèng phaûn öùng oxi hoùa khöû (xem SGK)
Vaäy: Zn + Cu2+ Zn2+ + Cu
Phaûn öùng treân xaây döïng töø 2 caëp oxi hoùa-khöû:
Zn2+/Zn vaø Cu2+/Cu
Moãi caëp oxi hoùa khöû coù 1 theá ñieän cöïc ñaëc tröng
oxi hoùa /khöû

Baøi taäp
Cho caùc phaûn öùng oxi hoùa –khöû, vieát caùc quaù trình khöû vaø
oxi hoùa xaûy ra trong phaûn öùng. Cho bieát caùc caëp oxi hoùa khöû
töông öùng cuûa phaûn öùng?
1.Al + CuSO4Cu + Al2(SO4)3
2.KMnO4+ KNO2+ H2SO4MnSO4+ KNO3+ H2O
3.HNO2+ Br2+ H2O HNO3+ HBr
4.FeCl3+ KI FeCl2 + I2+ KCl
5.Mn + Cl2+ 2NaOH Mn(OH)2+2NaCl
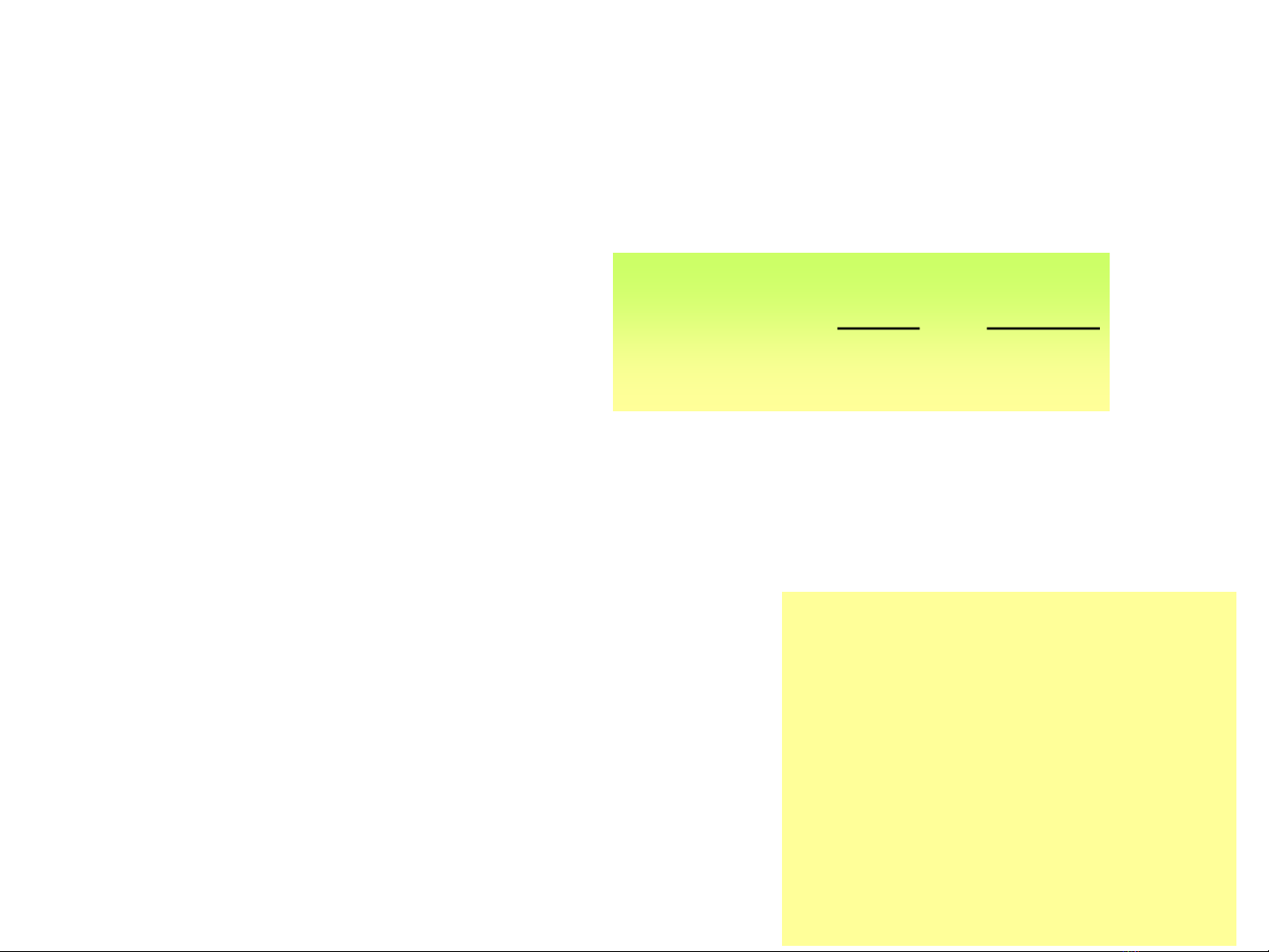
3.Theá ñieän cöïc –phöông trình Nernst
- Theá ñieän cöïc laø ñaïi löôïng theá hieäu ñaëc tröng cho
quaù trình ñieän cöïc hay ñieän cöïc, kyù hieäu laø .
]Kh[
]Ox[
ln
nF
RT
0
Phöông trình Nernst
n: soá electron trao ñoåi trong quaù trình ñieän cöïc;
[Ox], [Kh]: noàng ñoä caùc chaát tham gia daïng
oxyhoùa , daïng khöû;
F: soá Faraday (96484 culong/mol)
R: haèng soá khí (8,314 J/mol)
T: nhieät ñoä tuyeät ñoái.
phuï thuoäc:
- baûn chaát ñieän cöïc
- nhieät ñoä
- noàng ñoä
- Nồng độ muối lạ
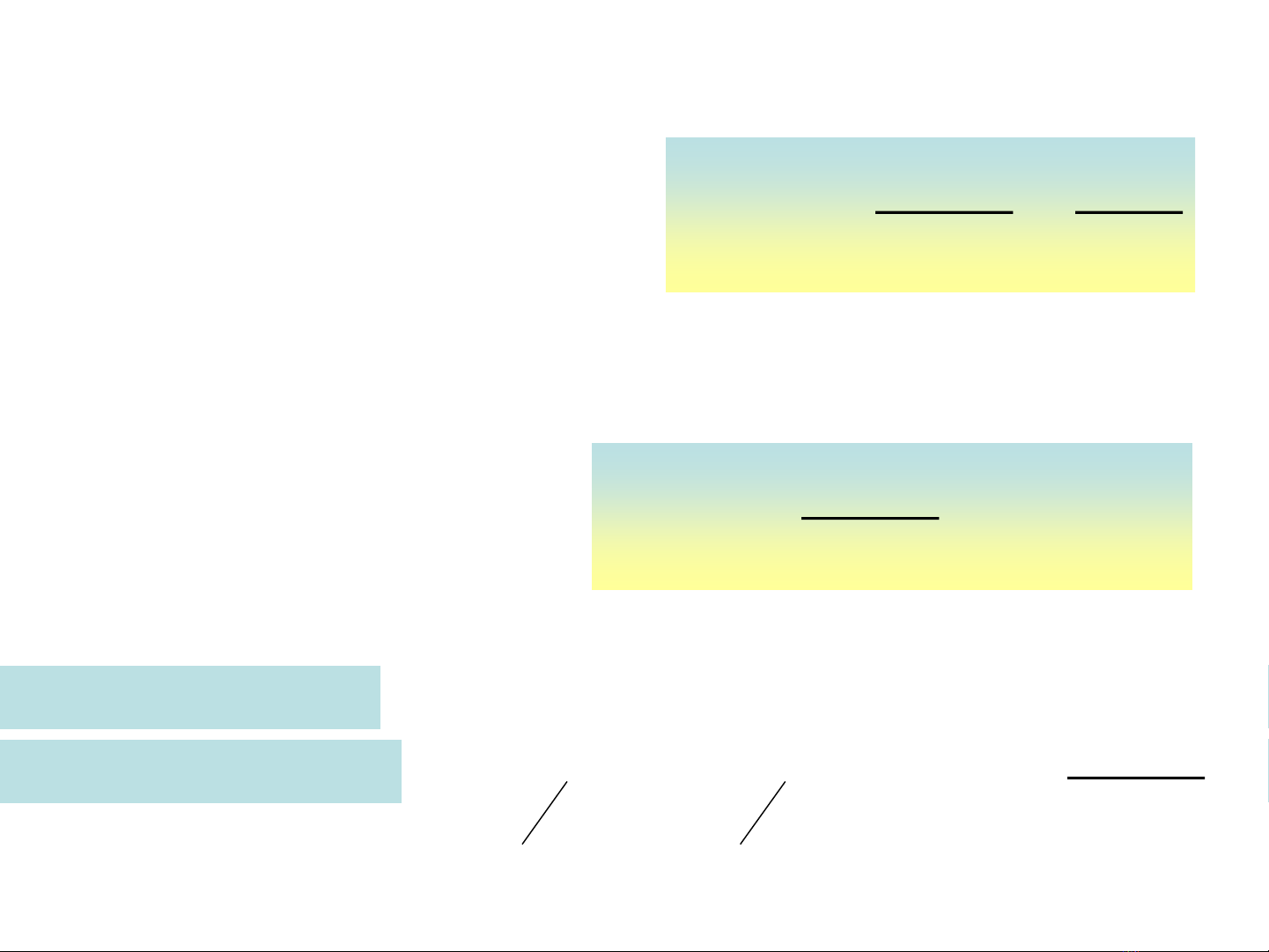
)2I2e(I V 535,0
)Cl22e(Cl V 358,1
Cu)2e(Cu V 0,337
Zn)2e(Zn V 0,763
2
0
/2II
2
0
/2ClCl
20
/CuCu
20
/ZnZn
-
2(l)
-
(k) 2
2
2
Ví duï: Baûng theá ñieän cöïc tieâu chuaån ÔÛ 250C ta coù:
ÔÛ ñk chuaån: C caùc chaát = 1
0
00, 059 [ ]
lg []
Ox
n Kh
Ñoái vôùi ñieän cöïc kim loaïi :
00, 059 lg[ ]oxihoa
n
33
22
3
2
[]
0, 059 lg []
o
Fe Fe
Fe Fe
Fe
Fe
Ví duï: Tính cuûa Fe3+/Fe2+ ôû 250C bieát [Fe3+] =0,5M , [Fe2+] =1M
= 0,77 + 0,059 lg0,5 (V)
Fe3+ + 1e Fe2+
0Fe3+/Fe2+ = + 0,77V


























