- 32 -
Assoc. Prof. Nguyễn Văn Nhận - Engineering Thermodynamics - 2007
Chương 3
QUÁ TRÌNH VÀ CHU TRÌNH NHIỆT ĐỘNG
3.1. KHÁI NIỆM CƠ BẢN
• Quá trình nhiệt động - quá trình thay đổi trạng thái của HNĐ. Trong quá
trình nhiệt động phải có ít nhất một thông số trạng thái thay đổi do có sự trao đổi nhiệt
và thực hiện công.
Quá trình nhiệt động cơ bản là quá trình nhiệt động trong đó có một thông số
trạng thái không đổi.
• Chu trình nhiệt động bao gồm hàng loạt quá trình nhiệt động kế tiếp nhau,
trong đó trạng thái của MCCT thay đổi liên tục rồi trở lại trạng thái ban đầu.
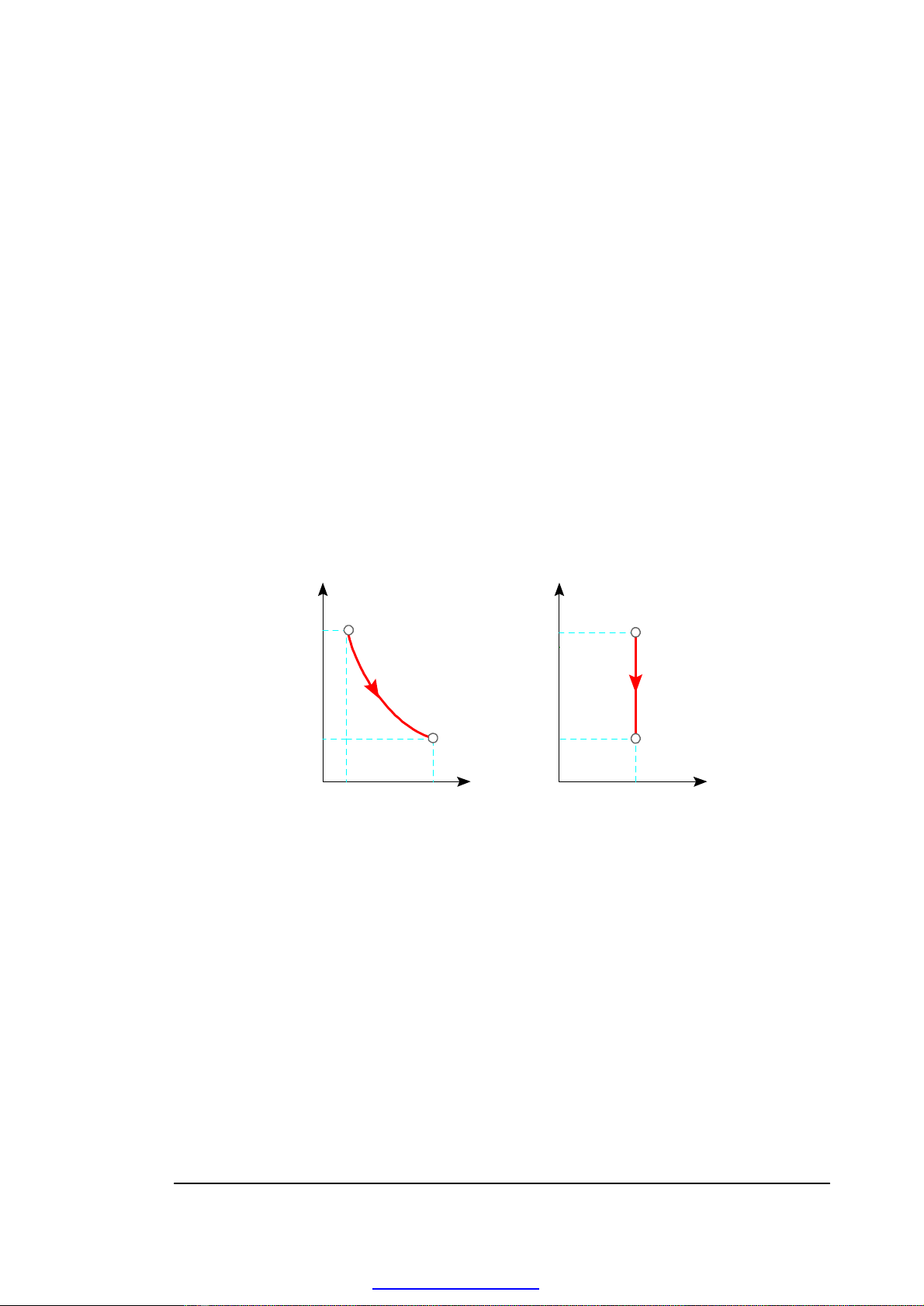
• Biểu diễn quá trình và chu trình nhiệt động -
p
1
2
p1
p2
0
VV2
V1
T
1
2
T1
T2
0
s
s1 = s2
H. 3-1. Quá trình nhiệt động trên đồ thị công (a) và đồ thị nhiệt (b)
Nội dung nghiên cứu quá trình nhiệt động :
1) Lập phương trình biểu diễn quá trình và xác định quan hệ giữa các thông số
nhiệt động cơ bản ở trạng thái đầu và cuối.
2) Xác định lượng thay đổi nội năng (∆u).
(
)
2
1
2121
|)
t
vt
uuuctt
∆=−=⋅− (3.1)
3) Tính công thực hiện trong quá trình (w).
dvpw
v
v
⋅= ∫2
1
(3.2)
PDF created with pdfFactory trial version www.pdffactory.com

- 33 -
Assoc. Prof. Nguyễn Văn Nhận - Engineering Thermodynamics - 2007
4) Tính lượng nhiệt tham gia quá trình (q)
• q = ∆u + w (3.3)
• ∫⋅= 2
1
T
T
dsTq (3.3b)
•
()
12
2
1
2
1
TTcdTcq T
T
T
T
−⋅=⋅= ∫ (3.3c)
5) Xác định lượng thay đổi enthalpy (∆i)
(
)
2
1
2121
|
t
pt
iiictt
∆=−=⋅−
(3..4)
6) Xác định lượng thay đổi entropy (∆s)
dq
ds
T
=
7) Biểu diễn quá trình trên đồ thị công và đồ thị nhiệt
3.2. QUÁ TRÌNH NHIỆT ĐỘNG CƠ BẢN CỦA KHÍ LÝ THƯỞNG
3.2.1. QUÁ TRÌNH ĐẲNG TÍCH
1) Phương trình biểu diễn quá trình đẳng tích
• Quá trình đẳng tích là quá trình diễn ra trong điều kiện thể tích của
MCCT không đổi.
• Phương trình trạng thái của MCCT trong quá trình dẳng tích :
p
T
= const (3.6a)
• Quan hệ giữa các thông số nhiệt động cơ bản ở trạng thái đầu và cuối :
2
2
1
1
T
p
T
p
=
hoặc
2
1
2
1
T
T
p
p= (3.6b)
2) Lượng thay đổi nội năng
∆u = c v . (T 2 - T 1) (3.6c)
3) Công thực hiện trong quá trình
w = 0 (3.6d)
4) Nhiệt lượng tham gia quá trình
q = c v . (T 2 - T 1) = ∆u (3.6e)
5) Lượng thay đổi enthalpy
∆i = c p . (T 2 - T 1) (3.6f)
PDF created with pdfFactory trial version www.pdffactory.com
- 34 -
Assoc. Prof. Nguyễn Văn Nhận - Engineering Thermodynamics - 2007
6) Lượng thay đổi entropy
T
dTc
T
dq
ds v⋅
==
1
2
1
2lnln p
p
c
T
T
cs vv ⋅=⋅=∆ (3.6g)
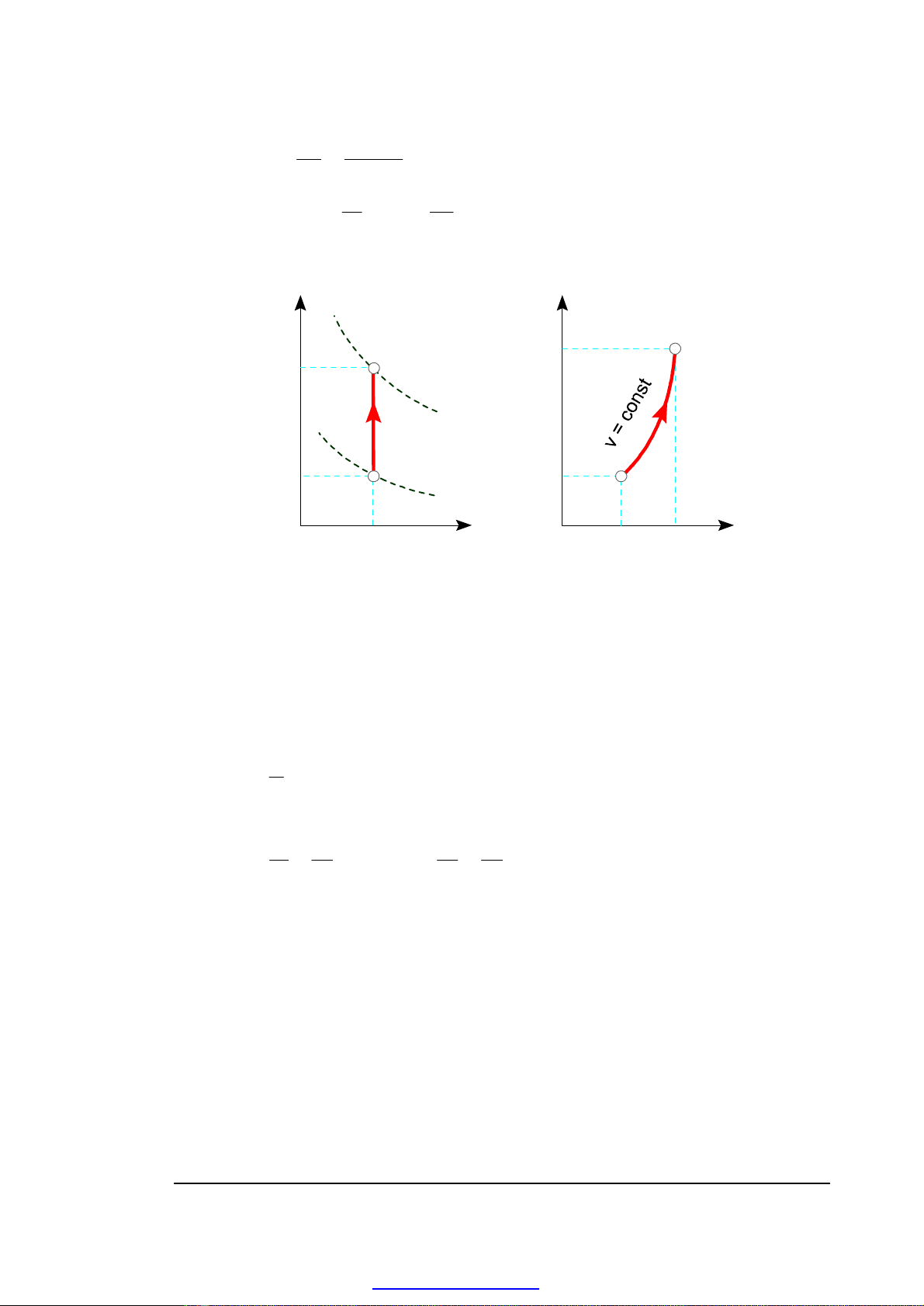
7) Biểu diễn quá trình đẳng tích trên đồ thị công và đồ thị nhiệt
p
1
2
p
2
p
1
V
V1 = V2
T
T
2
T
1
ss
2
s
1
1
2
T
2
T
1
H. 3-3. Quá trình đẳng tích trên đồ thị công và đồ thị nhiệt
3.2.2. QUÁ TRÌNH ĐẲNG ÁP
1) Phương trình quá trình đẳng áp
• Quá trình đẳng áp là quá trình diễn ra trong điều kiện áp suất của MCCT
không đổi.
• Phương trình trạng thái của MCCT trong quá trình đẳng áp :
v
T
= const (3.7a)
• Quan hệ giữa các thông số nhiệt động ở trạng thái đầu và cuối :
12
12
vv
TT
=
hoặc
11
22
vT
vT
=
(3.7b)
2) Lượng thay đổi nội năng
∆u = c v . (T 2 - T 1) (3.7c)
3) Công thực hiện trong quá trình
()
2
1
21
v
w=
v
pdvpvv
⋅=−
∫ (3.7d)
4) Nhiệt lượng tham gia quá trình
q = ∆u + w = cv (T2 - T1) + p(v2 - v1) (3.7e)
PDF created with pdfFactory trial version www.pdffactory.com
- 35 -
Assoc. Prof. Nguyễn Văn Nhận - Engineering Thermodynamics - 2007
5) Lượng thay đổi enthalpy
∆i = c p . (T 2 - T 1) (3.7f)
6) Lượng thay đổi entropy
p
cdT
dq
ds
TT
⋅
==
22
11
lnln
pp
Tv
scc
Tv
∆=⋅=⋅ (3.7g)
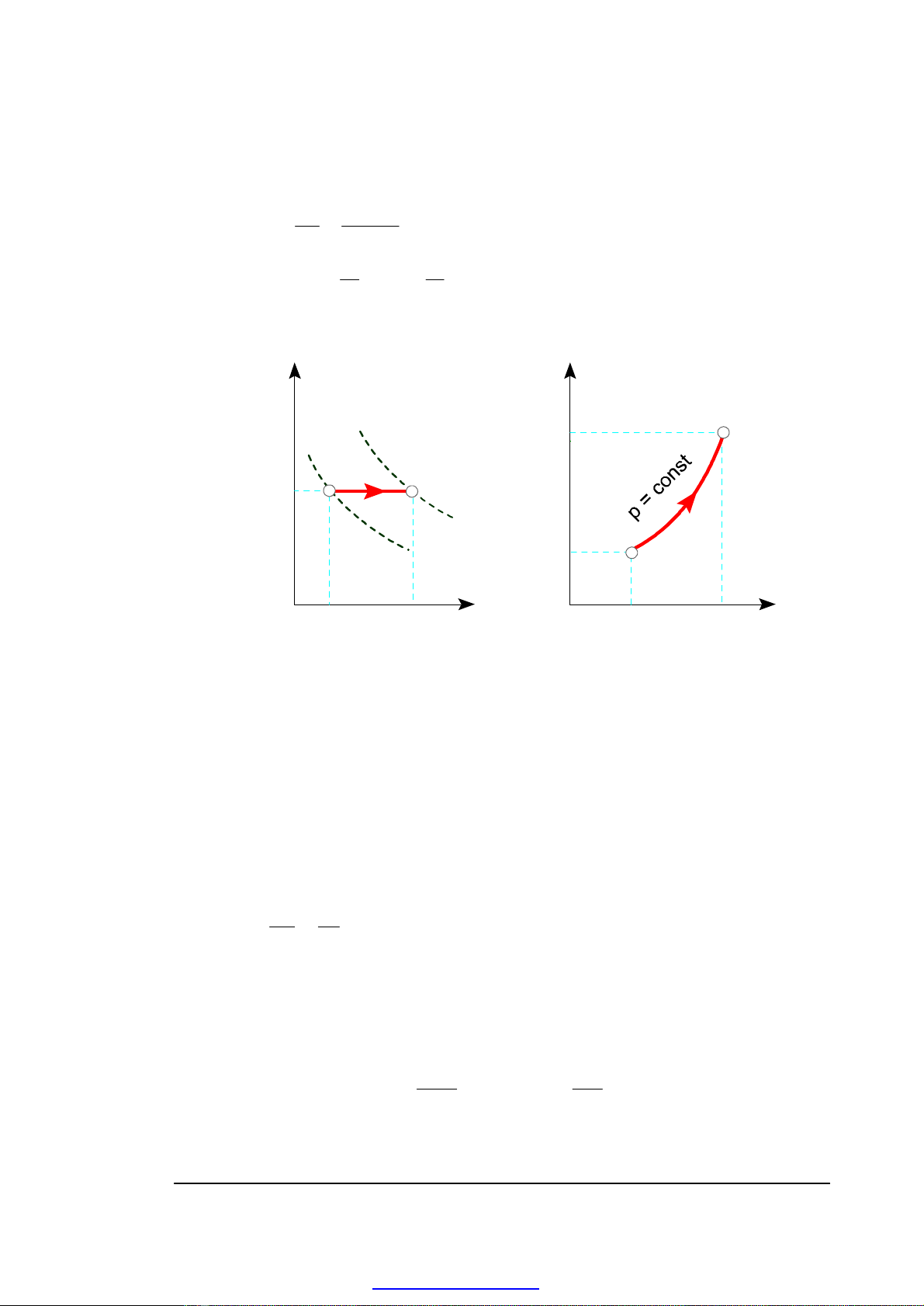
7) Biểu diễn quá trình đẳng áp trên đồ thị công và đồ thị nhiệt
p
1
2
p1 = p2
V
V1
T
T
2
T
1
ss2
s1
1
2
T
2
T
1
V2
H. 3-4. Quá trình đẳng áp trên đồ thị công và đồ thị nhiệt
3.2.3. QUÁ TRÌNH ĐẲNG NHIỆT
1) Phương trình quá trình đẳng nhiệt
• Quá trình đẳng nhiệt là quá trình diễn ra trong điều kiện nhiệt độ của
MCCT không đổi.
• Phương trình quá trình đẳng nhiệt :
pv = const (3.8a)
• Quan hệ giữa các thông số nhiệt động ở trạng thái đầu và cuối :
21
12
pv
pv
=
(3.8b)
2) Lượng thay đổi nội năng
∆u = 0 (3.8c)
3) Công thực hiện trong quá trình
222
111
v
w=
vvv
vv
RTdv
pdvdvRT
vv
==
∫∫∫
PDF created with pdfFactory trial version www.pdffactory.com

- 36 -
Assoc. Prof. Nguyễn Văn Nhận - Engineering Thermodynamics - 2007
21
12
v
w=RTlnln
v
p
RT
p
⋅=⋅ (3.8d)
4) Nhiệt lượng tham gia quá trình
q = ∆u + w = w (3.8e)
5) Lượng thay đổi enthalpy
∆i = 0 (3.9f)
6) Lượng thay đổi entropy
dqpdvdv
dsR
TTv
⋅
===⋅
21
12
lnln
vp
sRR
vp
∆=⋅=⋅ (3.7g)
7) Biểu diễn quá trình đẳng nhiệt trên đồ thị công và đồ thị nhiệt
p
1
2
p1
V
V1
p1
V2
T
12
T1 = T2
s
s1s2
H. 3-5. Quá trình đẳng nhiệt trên đồ thị công và đồ thị nhiệt
3.2.4. QUÁ TRÌNH ĐOẠN NHIỆT
1) Phương trình quá trình đoạn nhiệt
• Quá trình đoạn nhiệt - còn gọi là quá trình đẳng entropy - là quá trình
diễn ra trong điều kiện không có trao đổi nhiệt giữa HNĐ và MTXQ.
• Phương trình biểu diễn quá trình đoạn nhiệt :
onst
k
pvc= (3.9a)
trong đó k là chỉ số đoạn nhiệt.
• Quan hệ giữa các thông số nhiệt động cơ bản ở trạng thái đầu và cuối :
21
12
k
pv
pv
=
;
1
21
12
k
vp
vp
=
;
1
1
221
112
k
k
k
Tpv
Tpv
−
−
==
(3.9b)
2) Lượng thay đổi nội năng
∆u = cv .(T2 - T1) (3.9c)
PDF created with pdfFactory trial version www.pdffactory.com



![Câu hỏi ôn tập Kỹ thuật nhiệt [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250523/phongtrongkim2025/135x160/4471747999204.jpg)







![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)













