
Ngày nhận bài: 16-10-2024 / Ngày chấp nhận đăng bài: 20-11-2024 / Ngày đăng bài: 28-11-2024
*Tác giả liên hệ: Trương Ngọc Tuyền. Bộ môn Hóa hữu cơ - Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh,
Việt Nam. E-mail: truongtuyen@ump.edu.vn
© 2024 Bản quyền thuộc về Tạp chí Y học Thành phố Hồ Chí Minh.
36 https://www.tapchiyhoctphcm.vn
ISSN : 1859-1779
Nghiên cứu Dược học
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học;27(5):36-42
https://doi.org/10.32895/hcjm.p.2024.05.05
Bán tổng hợp một số dẫn chất cucurbitacin E tiềm năng
gây độc tế bào
Nguyễn Minh Thuận1, Thi Trần Hải Yến1, Lại Võ Trọng Nguyên1, Nguyễn Quí Hiển1, Lê Thị Hồng Vân1,
Trương Ngọc Tuyền1,*
1Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, Việt Nam
Tóm tắt
Đặt vấn đề: Việc phát triển thuốc hóa trị liệu đạt hiệu quả với độc tính thấp là cần thiết để đáp ứng nhu cầu điều trị nhiều
bệnh ung thư hiện nay. Cucurbitacin E được phân lập từ cây Dó bầu (Aquilaria crassna) thuộc họ Trầm hương
(Thymelaeaceae) có tiềm năng chống lại nhiều dòng tế bào ung thư nhưng do độc tính cao nên ứng dụng trên lâm sàng
của chất này còn hạn chế. Nghiên cứu này thực hiện bán tổng hợp các dẫn chất cucurbitacin E để tạo ra thư viện chất,
nhằm mục tiêu thử nghiệm các hoạt tính sinh học trong tương lai.
Mục tiêu: Tổng hợp các dẫn chất của cucurbitacin E - một chất được chiết từ các cây thuộc họ Bầu bí và Trầm hương
mà gần đây đang được thử nghiệm trên tế bào ung thư và có tác dụng độc tế bào.
Đối tượng và phương pháp nghiên cứu: Bán tổng hợp các dẫn chất của cucurbitacin E bằng phản ứng ngưng tụ tạo dẫn
chất benzopyrazin ở C2, C3 và phản ứng oxid hóa hoặc acyl hóa ở C16 qua hai bước.
Kết quả: Bảy dẫn chất của cucurbitacin E được tổng hợp với hiệu suất khá tốt (59 - 75%).
Kết luận: Các hợp chất được chứng minh độ tinh khiết và cấu trúc qua điểm nóng chảy, phổ IR, MS và NMR. Đây là tiền
đề cho các thử nghiệm tiếp theo về độc tế bào ung thư.
Từ khoá: cucurbitacin E, benzopyrazin, vi sóng, Dess-Martin periodinan (DMP)
Abstract
SEMI-SYNTHESIS OF CUCURBITACIN E DERIVATIVES WITH POTENTIAL
CYTOTOXICITY
Nguyen Minh Thuan, Thi Tran Hai Yen, Lai Vo Trong Nguyen, Nguyen Qui Hien, Le Thi Hong Van,
Truong Ngoc Tuyen

Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5 * 2024
https://doi.org/10.32895/hcjm.p.2024.05.05 https://www.tapchiyhoctphcm.vn | 37
Introduction: The development of effective chemotherapy drugs with low toxicity is essential to satisfy the needs for
cancer treatment. Although cucurbitacin E isolated from Aquilaria crassna in the Thymelaeaceae family has shown
potential against several cancer cell lines, there are limited clinical applications due to its high toxicity. This experiment
focuses on the semi-synthesis of cucurbitacin E derivatives to create a compound library for biological testing in the future.
Objectives: Semi-synthesis of cucurbitacin E derivatives - a compound extracted from plants in the Cucurbitaceae and
Thymelaeaceae families, which has recently been tested on cancer cells and shown cytotoxic effects.
Materials and methods: Semi-synthesis of some cucurbitacin E derivatives by condensation to obtain benzopyrazine
derivatives at C2, C3 and oxidation or acylation at C16 in two steps.
Results: Seven derivatives of cucurbitacin E were synthesized with modest to good yields (59 -75%).
Conclusion: The product’s purity and structural information were confirmed by melting point, IR, MS and NMR
spectroscopy. This serves as a foundation for future cytotoxicity tests on cancer cells.
Keywords: Cucurbitacin E; benzopyrazine; microwave; Dess-Martin periodinane (DMP)
1. ĐẶT VẤN ĐỀ
Việc phát triển các loại thuốc hóa trị liệu mới có hiệu quả
cao và ít độc tính là cần thiết nhằm đáp ứng nhu cầu điều trị
các bệnh ung thư hiện nay và cải thiện chất lượng cuộc sống
cho bệnh nhân [1]. Cucurbitacin E - một triterpenoid 4 vòng
được phân lập từ cây dó bầu (Aquilaria crassna) thuộc họ
Trầm hương (Thymelaeaceae) có tiềm năng chống lại nhiều
dòng tế bào ung thư nhưng do độc tính cao nên ứng dụng
trên lâm sàng của chất này còn hạn chế [2,3]. Năm 2004,
Halaweish F.T. và cộng sự đã chứng minh khả năng gây độc
tế bào ung thư gan (HepG2) tăng tỉ lệ thuận với chuỗi alkyl
của OH ở C2 [4]. Năm 2012, Lang KL và cộng sự cho thấy
việc acyl hoặc oxid hóa OH tại C16 làm giảm độc tính trên
tế bào ung thư A549 [5]. Năm 2022, Wang H và cộng sự đã
chiết xuất, phân lập các hợp chất chứa dị vòng pyrazin trong
khung cucurbitan có hoạt tính gây độc tế bào ung thư đáng
kể [6]. Vì vậy, nghiên cứu này được thực hiện để tạo ra
thư viện các dẫn chất cucurbitacin E. Các dẫn chất này sẽ
được tiến hành thử nghiệm độc tế bào trên một số dòng tế
bào ung thư.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP
NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Biến đổi cấu trúc ở vị trí C2, C3 (chất 1) tạo dẫn chất
benzopyrazin với hỗ trợ vi sóng. Ở vị trí C16 nhóm OH được
tạo các dẫn chất bằng phản ứng oxid hóa (2 và 3) hoặc acyl
hóa (4-7) thông qua giai đoạn trung gian ether được tóm tắt
bằng sơ đồ trong Hình 1.
2.2. Phương pháp nghiên cứu
2.2.1. Nguyên liệu và thiết bị
Cucurbitacin E từ Bộ môn Dược liệu - Dược học cổ truyền,
Đại học Y Dược Thành phố Hồ Chí Minh. Hóa chất và dung
môi sử dụng trực tiếp không qua tinh chế (Merck,
Fischer Scientific, Xilong). Sắc ký lớp mỏng sử dụng
bản nhôm silica gel 60 F254 dùng để theo dõi và kiểm
tra phản ứng; sắc ký cột (SKC) sử dụng silica gel 60
(Merck). Điểm nóng chảy (MP) đo bằng máy Sanyo-
Gallenkamp. Phổ hồng ngoại (IR) đo bằng máy
Shimadzu IRAffinity-1S tại khoa Dược, đại học Y
Dược Thành phố Hồ Chí Minh. Phổ khối phân giải cao
(HR-MS) đo bằng máy sắc ký lỏng Shimadzu LC20A
ghép nối đầu dò LCMS IT-TOF của Viện Kiểm Nghiệm
Thuốc Thành phố Hồ Chí Minh. Phổ cộng hưởng từ hạt
nhân (1H-NMR, 13C-NMR) đo bằng máy Bruker
AvanceNeo 600-150 MHz tại Viện Hàn lâm Khoa học-Công
nghệ, Hà Nội.
2.2.2. Phương pháp nghiên cứu
Hợp chất 1
Cho hỗn hợp cucurbitacin E (0,2 mmol, 111 mg); benzen-
1,2-diamin (0,4 mmol, 43 mg) và dung môi acetonitril-acid
acetic (9:1) trong argon vào máy vi sóng CEM Discovery [7]
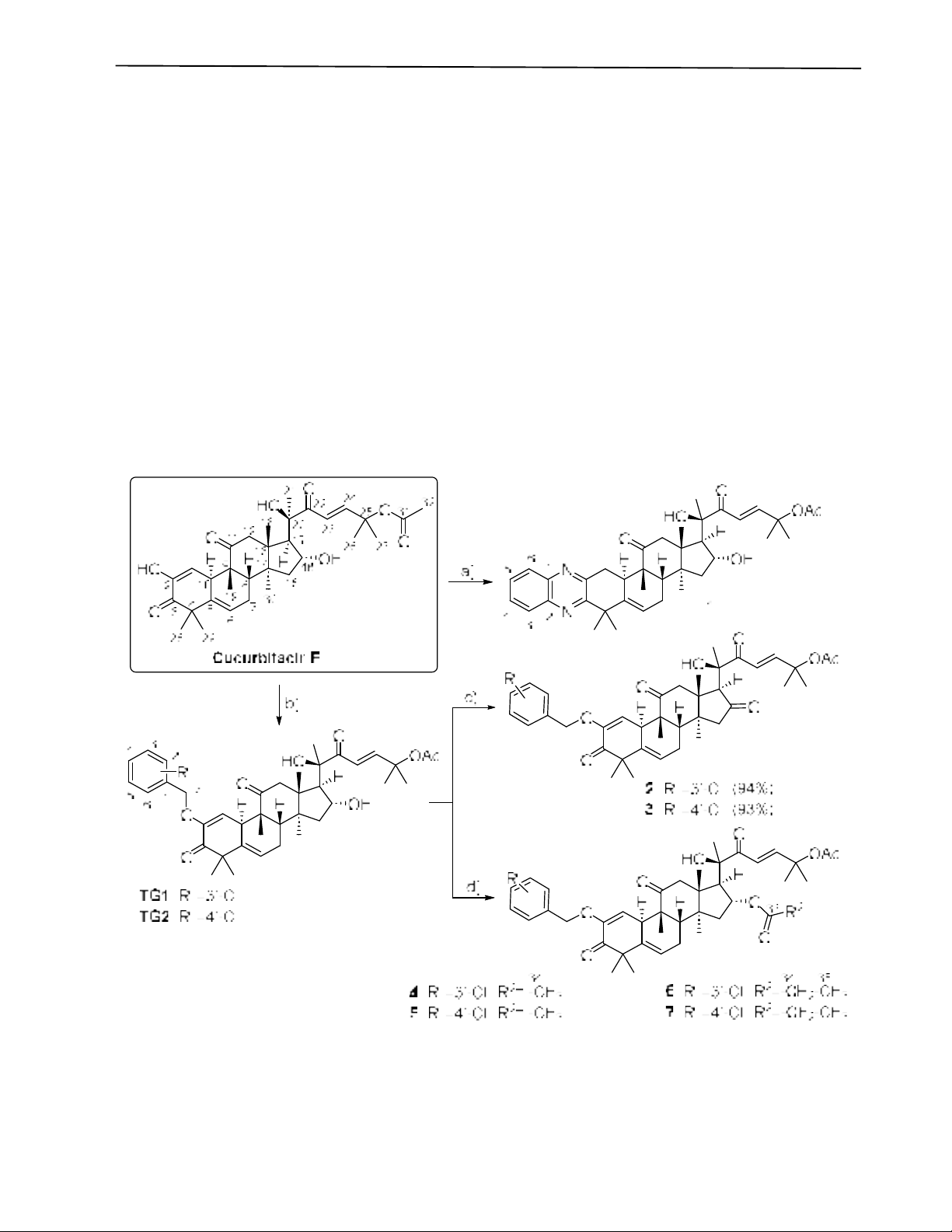
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5* 2024
38 | https://www.tapchiyhoctphcm.vn https://doi.org/10.32895/hcjm.p.2024.05.05
cài đặt ở 140 - 145 oC và 200 W trong 1 giờ. Hỗn hợp sau
đó được cô quay, pha loãng bằng CHCl3, rửa với dung dịch
HCl 3 M và NaCl bão hòa, cô quay loại dung môi. Sản phẩm
được tinh chế bằng SKC với hệ dung môi (n-Hexan-CHCl3-
EtOAc-Et3N 2%).
TG1, 2
Đun hồi lưu cucurbitacin E (0,2 mmol, 113 mg),
K2CO3 (0,5 mmol; 69 mg) trong aceton. Sau đó thêm
tiếp 3-clorobenzyl bromid (0,24 mmol, 32 mL) và KI
(0,1 mmol, 16 mg) và tiếp tục đun hồi lưu. Khi phản ứng kết
thúc, cô quay loại dung môi, chiết lại bằng dicloromethan
(DCM), rửa lớp hữu cơ với nước và NaCl bão hòa, cô quay
loại dung môi. Sản phẩm được tinh chế bằng SKC với hệ
dung môi (DCM-EtOAc).
Hợp chất 2, 3
Hỗn hợp TG1 hoặc TG2 (0,2 mmol), tác nhân Dess-
Martin (DMP) (0,6 mmol, 254 mg) và NaHCO3 (1,2 mmol,
101 mg) được khuấy trong DCM [8]. Khi phản ứng kết thúc,
thêm dung dịch bão hòa NaHCO3, Na2S2O3 vào, chiết sản
phẩm bằng DCM, rửa với NaCl bão hòa, cô quay loại dung
môi. Sản phẩm được tinh chế bằng SKC với hệ dung môi
(DCM-EtOAc).
Hợp chất 4-7
Hỗn hợp TG1 hoặc TG2 (0,54 mmol), Ac2O hoặc
(EtCO)2O (3,24 mmol), DMAP (50 mol%, 32 mg) và
pyridin 0,3 mL được khuấy trong DCM. Sau khi phản ứng
kết thúc, pha loãng bằng DCM, rửa với HCl 1 M và NaCl
bão hòa, cô quay loại dung môi. Sản phẩm được tinh chế
bằng SKC với hệ dung môi (n-hexan-EtOAc).
Điều kiện: (a) benzen-1,2-diamin, MeCN-AcOH (9:1), 140 - 145 oC, argon, 1 h, vi sóng, 200 W; (b) clorobenzyl bromid, K2CO3, aceton, KI, hồi
lưu; (c) DMP, DCM, NaHCO3, r.t; (d) Ac2O hoặc (EtCO)2O, DCM, pyridin, DMAP, r.t
Hình 1. Sơ đồ tổng hợp các dẫn chất của cucurbitacin E

Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5 * 2024
https://doi.org/10.32895/hcjm.p.2024.05.05 https://www.tapchiyhoctphcm.vn | 39
3. KẾT QUẢ
3.1. Hợp chất 1 (C38H48N2O6)
Bột mịn màu vàng nhạt (hiệu suất 63%). FT-IR (ν, cm-1):
2974 (C-HAr), 2927 (C-HAliphatic), 1734 (C=O), 1689 (C=N),
1124 (C-O). MP: 124 - 127 oC. HR-MS (ESI, m/z) [M+H]+
dự kiến 629,3585; tìm thấy 629,3563. 1H-NMR (CDCl3-600
MHz)
: 8,02 (1H, t, J = 4,8 Hz); 7,98 (1H, t, J = 4,8 Hz);
7,66 (2H, p, J = 4,8 Hz); 7,00 (1H, d, J = 15,6 Hz); 6,37 (1H,
d, J = 15,6 Hz); 6,03 (1H, t, J = 2,7 Hz); 4,35 (1H, t, J = 8,1
Hz); 4,26 (1H, s); 3,13 (1H, dd, J = 15,5; 4,0 Hz); 3,09 (1H,
d, J = 14,6 Hz); 2,88 (1H, dd, J = 15,4; 12,9 Hz); 2,69 (1H,
d, J = 12,2 Hz); 2,64 (1H, d, J = 14,5 Hz); 2,50 (1H,
ddt, J = 19,1; 7,0; 3,1 Hz); 2,42 (1H, d, J = 7,1 Hz); 2,09 (1H,
ddd, J = 19,2; 5,6; 2,3 Hz); 2,03 (1H, d, J = 8,1 Hz); 1,95
(3H, s); 1,89 (1H, dd, J = 13,5; 9,2 Hz); 1,71 (3H, s); 1,49
(3H, s); 1,48 (3H, s); 1,45 - 1,46 (1H, m); 1,46 (3H, s); 1,38
(3H, s); 1,30 (3H, s); 1,23 (3H, s); 0,99 (3H, s). 13C-NMR
(CDCl3-150 MHz)
: 212,6; 202,7; 170,3; 159,5; 153,6;
152,0; 142,2; 141,1; 141,0; 129,2; 129,1; 128,8; 128,5;
120,9; 120,5; 79,4; 78,3; 71,5; 58,3; 50,9; 49,0; 48,9; 48,4;
45,7; 43,6; 42,6; 36,8; 33,5; 32,0; 29,8; 26,5; 26,1; 24,2;
24,1; 22,0; 19,9; 19,5; 18,9.
3.2. TG1 (C39H49ClO8)
Bột mịn màu vàng (hiệu suất 80%). FT-IR (ν, cm-1): 3464
(O-H), 2978 (C-HAr), 2932 (C-HAliphatic), 1689 (C=O),
1249 (C-O), 787 (C-Cl). MP: 83-86 oC. HR-MS (ESI,
m/z) [M+Na]+ dự kiến 703,3008; tìm thấy 703,3011.
3.3. TG2 (C39H49ClO8)
Bột vô định hình màu vàng (hiệu suất 76%). FT-IR
(ν, cm-1): 3449 (O-H), 2978 (C-HAr), 2924 (C-HAliphatic),
1689 (C=O), 1242 (C-O), 810 (C-Cl). MP: 102-106 oC.
HR-MS (ESI, m/z) [M+Na]+ dự kiến 703,3008, tìm
thấy 703,3017.
3.4. Hợp chất 2 (C39H47ClO8)
Bột vô định hình màu vàng (hiệu suất 94%). FT-IR
(ν, cm-1): 3479 (O-H), 2978 (C-HAr), 2939 (C-HAliphatic),
1689 (C=O), 1242 (C-O), 787 (C-Cl). MP: 70 - 71 oC.
MS (ESI, m/z) [M+H]+ dự kiến 679,30; tìm thấy
679,30. 1H-NMR (CDCl3-600 MHz) : 7,40 (1H, s);
7,32 - 7,25 (3H, m); 7,03 (1H, d, J = 15,6 Hz); 6,66 (1H, d,
J = 15,6 Hz); 5,77 (1H, t, J = 2,4 Hz); 5,64 (1H, d, J = 2,4
Hz); 4,90 (1H, d, J = 12,6 Hz); 4,82 (1H, d, J = 12,6 Hz); 3,73
(1H, s); 3,51 (1H, s); 3,48 (1H, s); 3,28 (1H, d, J = 15 Hz);
2,79 (1H, d, J = 15 Hz); 2,46 - 2,41 (1H, m); 2,25 (1H, d,
J = 8,4 Hz); 2,16 (1H, d, J = 17,4 Hz); 2,09 (1H, d, J = 17,4
Hz); 2,01 (3H, s), 1,96 (1H, ddd, J = 19,8; 5,4; 1,8 Hz); 1,56
(3H, s); 1,55 (3H, s); 1,39 (3H, s); 1,34 (3H, s); 1,33 (3H, s);
1,25 (3H, s); 1,07 (3H, s); 0,89 (3H, s). 13C-NMR (CDCl3-
150 MHz)
: 215,3; 211,7; 202,3; 196,5; 169,8; 152,2; 147,7;
138,3; 136,7; 134,5; 129,8; 128,1; 127,5; 125,5; 120,1;
119,6; 114,9; 79,4; 79,0; 69,0; 62,0; 49,7; 49,5; 49,1; 47,9;
47,4; 44,2; 41,3; 35,1; 27,4; 26,4; 26,2; 23,8; 23,7; 21,9;
20,3; 19,7; 19,6; 18,6.
3.5. Hợp chất 3 (C39H47ClO8)
Bột mịn màu vàng (hiệu suất 93%). FT-IR (ν, cm-1): 3495
(O-H), 2978 (C-HAr), 2938 (C-HAliphatic), 1688 (C=O), 1231
(C-O), 790 (C-Cl). MP: 81-84 oC. HR-MS (ESI, m/z)
[M-H]- dự kiến 677,2887; tìm thấy 677,2873. 1H-NMR
(CDCl3-600 MHz)
: 7,33 (4H, s); 7,02 (1H, d, J = 15,7 Hz);
6,65 (1H, d, J = 15,7 Hz); 5,75 (1H, t, J = 2,4 Hz); 5,62 (1H,
d, J = 3 Hz); 4,88 (1H, d, J = 12,5 Hz); 4,82 (1H, d, J = 12,5
Hz); 3,72 (1H, s); 3,51 (1H, s); 3,46 (1H, s); 3,27 (1H,
d, J = 13,2 Hz); 2,77 (1H, d, J = 15 Hz); 2,42 (1H, ddt,
J = 19,8; 8,4; 3 Hz); 2,24 (1H, d, J = 8,4 Hz); 2,16 (1H,
d, J = 18 Hz); 2,08 (1H, d, J = 18 Hz); 2,01 (3H, s), 1,95 (1H,
ddd, J = 19,6; 5,3; 2,0 Hz); 1,55 (3H, s); 1,54 (3H, s); 1,38
(3H, s); 1,33 (3H, s); 1,31 (3H, s); 1,22 (3H, s); 1,06 (3H, s);
0,87 (3H, s). 13C-NMR (CDCl3-125 MHz)
: 215,3; 211,8;
202,3; 196,6; 169,8; 152,2; 147,7; 136,8; 134,9; 133,8;
128,79; 128,76; 120,0; 119,6; 114,9; 79,5; 79,1; 69,0; 61,9;
49,7; 49,5; 49,1; 47,9; 47,5; 44,2; 41,3; 35,1; 27,5; 26,5;
26,2; 23,9; 23,8; 21,9; 20,4; 19,8; 19,6; 18,6.
3.6. Hợp chất 4 (C41H51ClO9)
Bột mịn màu vàng (hiệu suất 89%). FT-IR (ν, cm-1): 3441
(O-H), 2978 (C-HAr), 2939 (C-HAliphatic), 1689 (C=O), 1242
(C-O), 879 (C-Cl). MP: 103-108 oC. HR-MS (ESI, m/z)
[M+Na]+ dự kiến 745,3114; tìm thấy 745,3111. 1H-NMR
(CDCl3-600 MHz)
: 7,39 (1H, s); 7,31 - 7,25 (3H, m); 7,14

Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5* 2024
40 | https://www.tapchiyhoctphcm.vn https://doi.org/10.32895/hcjm.p.2024.05.05
(1H, d, J = 15,5 Hz); 6,39 (1H, d, J = 15,6 Hz); 5,74 (1H, dt,
J = 5,1; 2,5 Hz); 5,64 (1H, d, J = 2,4 Hz); 5,20 (1H, ddd,
J = 9,0; 7,5; 1,5 Hz); 4,87 (1H, d, J = 12,6 Hz); 4,81 (1H, d,
J = 12,6 Hz); 4,27 (1H, s); 3,44 (1H, t, J = 2,4 Hz); 3,21 (1H,
d, J = 14,4 Hz); 2,75 (1H, d, J = 14,4 Hz); 2,68 (1H, d,
J = 7,2 Hz); 2,35 (1H, ddt, J = 19,6; 8,5; 3 Hz); 2,03 (1H, d,
J = 9,6 Hz); 2,02 (3H, s); 1,99 (1H, d, J = 8,4 Hz); 1,95 (1H,
ddd, J = 19,7; 5,2; 2 Hz); 1,86 (3H, s); 1,57 (3H, s); 1,56 (3H,
s); 1,41 (3H, s); 1,40 (1H, d, J = 14,4 Hz); 1,32 (3H, s); 1,31
(3H, s); 1,22 (3H, s); 1,02 (3H, s); 0,85 (3H, s). 13C-NMR
(CDCl3-150 MHz)
: 212,9; 200,9; 196,6; 170,3; 169,6;
152,6; 147,6; 138,4; 136,5; 134,6; 129,9; 128,1; 127,4;
125,5; 120,5; 119,3; 115,3; 79,1; 77,7; 73,5; 69,0; 54,2; 49,9;
49,1; 48,9; 48,7; 48,0; 43,4; 41,3; 35,0; 27,5; 26,6; 26,4;
23,7; 23,5; 21,8; 20,6; 20,4; 19,82; 19,76; 18,3.
3.7. Hợp chất 5 (C41H51ClO9)
Bột mịn màu vàng (hiệu suất 78%). FT-IR (ν, cm-1): 3449
(O-H), 2978 (C-HAr), 2932 (C- HAliphatic), 1689 (C=O), 1242
(C-O), 810 (C-Cl). MP: 108 - 112 oC. HR-MS (ESI, m/z)
[M+Na]+ dự kiến 745,3114; tìm thấy 745,3110. 1H-NMR
(CDCl3-600 MHz)
: 7,33 (4H, s); 7,14 (1H, d, J = 15,6
Hz); 6,39 (1H, d, J = 15,6 Hz); 5,74 (1H, t, J = 2,7 Hz);
5,64 (1H, d, J = 2,4 Hz); 5,20 (1H, t, J = 7,5 Hz); 4,87
(1H, d, J = 12,6 Hz); 4,81 (1H, d, J = 12,6 Hz); 4,27 (1H,
s); 3,44 (1H, br s); 3,21 (1H, d, J = 15 Hz); 2,75 (1H,
d, J = 15 Hz); 2,68 (1H, d, J = 7,2 Hz); 2,35 (1H, ddt,
J = 19,2; 8,7; 2,7 Hz); 2,04 - 2,03 (1H, m); 2,02 (3H, s); 1,99
(1H, dd, J = 15; 8,7 Hz); 1,95 (1H, ddd, J = 19,5; 5,4; 2,1
Hz); 1,86 (3H, s); 1,57 (3H, s); 1,56 (3H, s); 1,41 (3H, s);
1,39 - 1,41 (1H, m); 1,31 (3H, s); 1,30 (3H, s); 1,20 (3H,
s); 1,02 (3H, s); 0,83 (3H, s). 13C-NMR (CDCl3-150
MHz)
: 212,9; 200,9; 196,7; 170,3; 169,6; 152,6; 147,6;
136,5; 134,9; 133,7; 128,7; 120,4; 119,3; 115,2; 79,1;
77,7; 73,5; 68,9; 54,2; 49,8; 49,0; 48,9; 48,7; 48,0; 43,3;
41,3; 35,0; 27,5; 26,6; 26,3; 23,7; 23,5; 21,8; 20,6; 20,4;
19,8; 19,7; 18,2.
3.8. Hợp chất 6 (C42H53ClO9)
Bột mịn màu vàng (hiệu suất 82%). FT-IR (ν, cm-1): 3449
(O-H), 2978 (C-HAr), 2939 (C-HAliphatic), 1689 (C=O), 1180
(C-O), 779 (C-Cl). MP: 83 - 86 oC. HR-MS (ESI, m/z)
[M+Na]+ dự kiến 759,3270; tìm thấy 759,3283. 1H-NMR
(CDCl3-600 MHz) : 7,39 (1H, s); 7,25 - 7,31 (3H, m);
7,11 (1H, d, J = 15,6 Hz); 6,40 (1H, d, J = 15,6 Hz); 5,74
(1H, dt, J = 5,2; 2,6 Hz); 5,64 (1H, d, J = 2,7 Hz); 5,21
(1H, t, J = 7,5 Hz); 4,87 (1H, d, J = 12,6 Hz); 4,81 (1H, d,
J = 12,6 Hz); 4,27 (1H, s); 3,44 (1H, br s); 3,21 (1H, d,
J = 13,2 Hz); 2,76 (1H, d, J = 14,4 Hz); 2,68 (1H, d,
J = 7,8 Hz); 2,35 (1H, dt, J = 19,6; 8,6; 2,9 Hz); 2,11 (2H,
q, J = 7,5 Hz); 2,01 - 2,04 (1H, m); 2,02 (3H, s); 1,99 (1H,
dd, J = 9,2; 1,5 Hz); 1,95 (1H, ddd, J = 19,7; 5,3; 2,0 Hz);
1,57 (6H, s); 1,41 (3H, s); 1,38 - 1,41 (1H, m); 1,31 (6H,
s); 1,22 (3H, s); 1,04 (3H, t, J = 7,6 Hz); 1,02 (3H, s); 0,85
(3H, s). 13C-NMR (CDCl3-150 MHz)
: 212,9; 200,9;
196,7; 170,7; 169,6; 152,4; 147,6; 138,4; 136,5; 134,6;
129,9; 128,1; 127,5; 125,5; 120,5; 119,4; 115,3; 79,1;
77,7; 73,4; 69,0; 54,3; 49,9; 49,1; 48,9; 48,7; 48,0; 43,5;
41,3; 35,0; 27,5; 27,3; 26,43; 26,38; 23,8; 23,5; 21,9;
20,4; 19,8; 19,7; 18,2; 8,9.
3.9. Hợp chất 7 (C42H53ClO9)
Bột mịn màu vàng (hiệu suất 83%). FT-IR (ν, cm-1): 3445
(O-H), 2978 (C-HAr), 2938 (C-HAliphatic),1689 (C=O), 1181
(C-O), 780 (C-Cl). MP: 102 - 104 oC. HR-MS (ESI, m/z)
[M-H]- dự kiến 735,3305; tìm thấy 735,3328. 1H-NMR
(CDCl3-600 MHz)
: 7,32 (4H, s); 7,10 (1H, d, J = 15,6 Hz);
6,40 (1H, d, J = 15,6 Hz); 5,72 (1H, t, J = 2,6 Hz); 5,62 (1H,
d, J = 2,4 Hz); 5,20 (1H, t, J = 7,5 Hz); 4,86 (1H, d,
J = 12,6 Hz); 4,82 (1H, d, J = 12,6 Hz); 3,44 (1H, t, J = 2,7 Hz);
3,21 (1H, d, J = 14,4 Hz); 2,76 (1H, d, J = 15 Hz); 2,68
(1H, d, J = 7,8 Hz); 2,35 (1H, ddt, J = 19,5; 8,3; 2,8 Hz);
2,10 (2H, q, J = 7,5 Hz); 2,00 - 2,03 (1H, m); 2,00 (3H, s); 1,98
(1H, d, J = 9 Hz); 1,94 (1H, ddd, J = 19,6; 5,2; 2,1 Hz); 1,55
(6H, s); 1,40 (3H, s); 1,37 (1H, d, J = 15,6 Hz); 1,30 (3H, s);
1,29 (3H, s); 1,20 (3H, s); 1,03 (3H, t, J = 7,6 Hz); 1,01
(3H, s); 0,82 (3H, s). 13C-NMR (CDCl3-125 MHz)
:
213,0; 200,9; 196,8; 173,7; 169,6; 152,4; 147,6; 136,4;
134,9; 133,7; 128,8; 128,7; 120,5; 119,4; 115,3; 79,2;
77,7; 73,4; 69,0; 54,3; 49,9; 49,0; 48,9; 48,7; 48,0; 43,5;
41,3; 35,0; 27,5; 27,2; 26,43; 26,37; 23,8; 23,5; 21,9;
20,4; 19,8; 19,7; 18,2; 8,9.
4. BÀN LUẬN
Trong nghiên cứu này, hai dẫn chất trung gian TG1 và
TG2 chỉ cung cấp phổ IR và MS để sơ bộ xác định cấu trúc








![Đánh giá tác dụng tăng lực của viên nang Linh Lộc Sơn trên thực nghiệm: [Phân tích chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250228/viinuzuka/135x160/7461740737076.jpg)














![Giáo trình Bệnh học nội khoa - Trường Cao đẳng Y dược Hà Nội [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251209/laphong0906/135x160/51721770719192.jpg)


