B Y TỘ Ế
C C QU N LÝ D CỤ Ả ƯỢ
-------
C NG HÒA XÃ H I CH NGHĨA VI T NAMỘ Ộ Ủ Ệ
Đc l p - T do - H nh phúc ộ ậ ự ạ
---------------
S : ố17362/QLD-CL
V/v các h s đ ngh công b c s ồ ơ ề ị ố ơ ở
s n xu t thu c đt tiêu chu n PIC/S-ả ấ ố ạ ẩ
GMP và EU-GMP không đt yêu c u và ạ ầ
c n b sung gi i trình (Đầ ổ ả ợt 68)
Hà N iộ, ngày 10 tháng 10 năm 2019
Kính g i:ử……………………………………………….
Căn c Thông t s 11/2016/TT-BYT ngày 11/05/2016 c a B Y t Quy đnh vi c đu th u ứ ư ố ủ ộ ế ị ệ ấ ầ
thu c t i các c s y t công l p;ố ạ ơ ở ế ậ
C c Qu n lý D c thông báo cho các doanh nghi p có h s đ ngh công b c s s n xu t ụ ả ượ ệ ồ ơ ề ị ố ơ ở ả ấ
thu c đt tiêu chu n PIC/S - GMP và Eố ạ ẩ U - GMP không đt yêu c u và c n b sung gi i trình ạ ầ ầ ổ ả
trong Đt 68 theo các danh sách nh sau:ợ ư
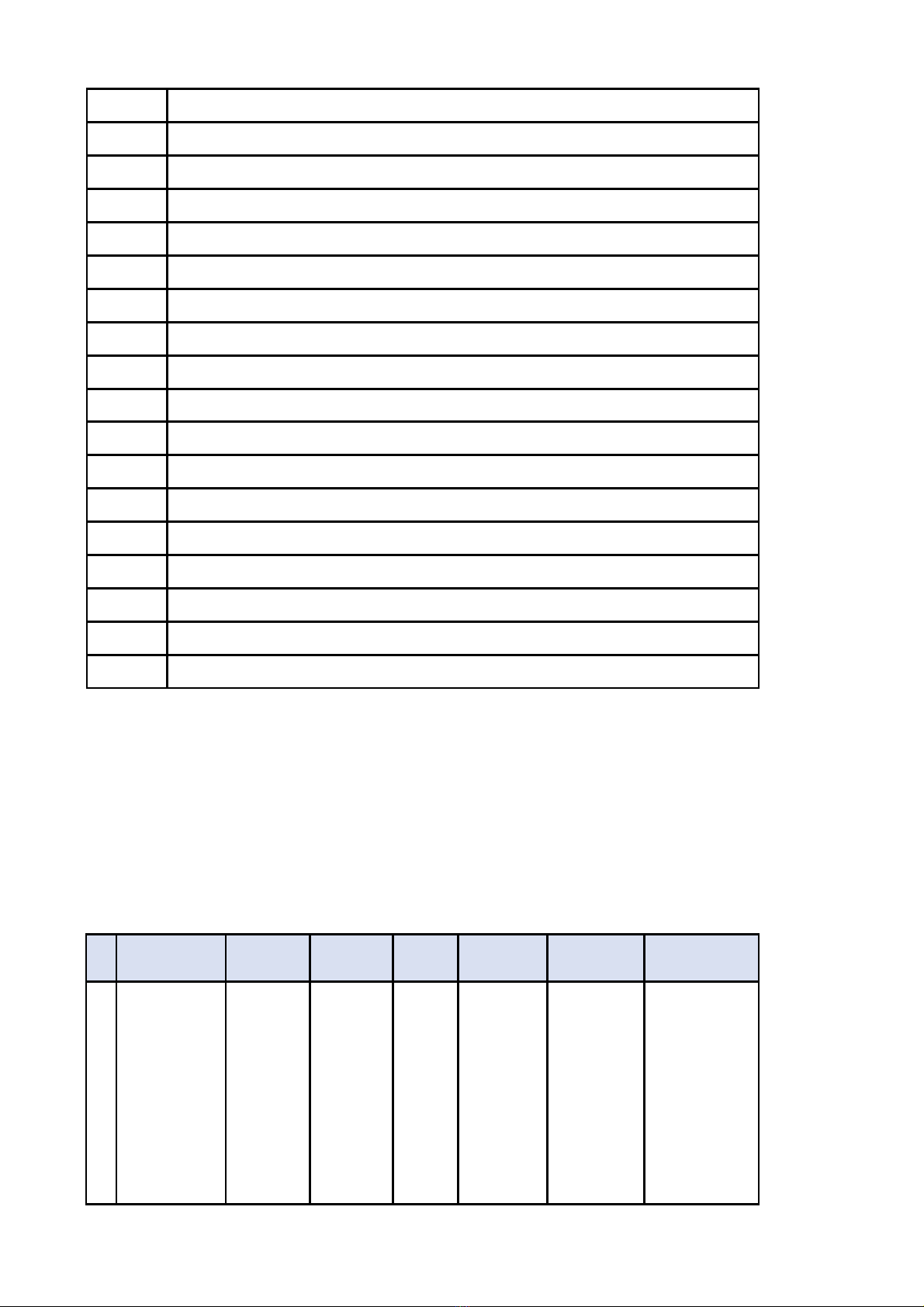
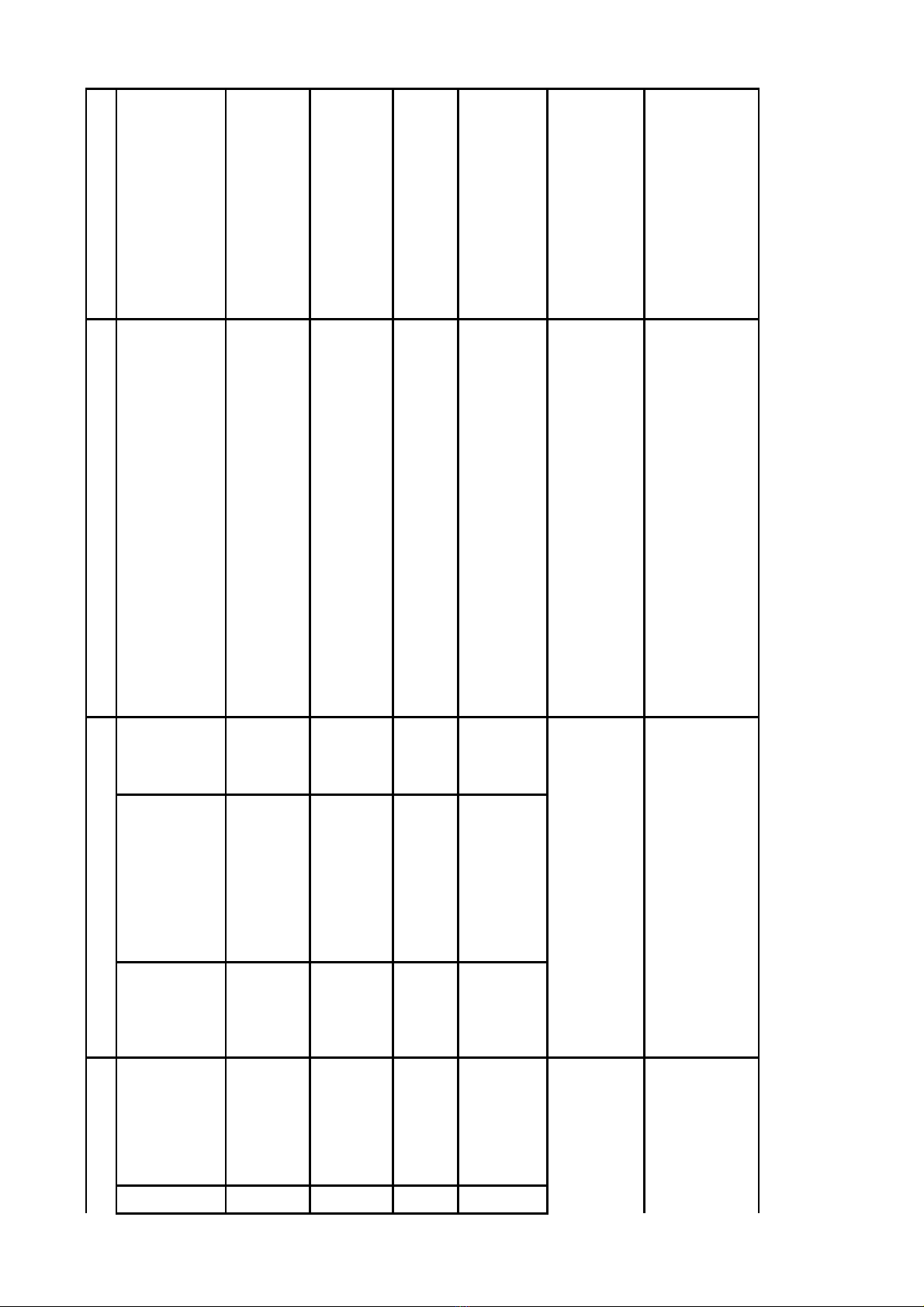
Ph l c 1:ụ ụ Danh sách các h s đ ngh công b c s s n xu t thu c đt tiêu chu n PIC/S - ồ ơ ề ị ố ơ ở ả ấ ố ạ ẩ
GMP và EU - GMP không đt yêu c u (Đt 68): Trong danh sách đã nêu rõ lý do h s không đtạ ầ ợ ồ ơ ạ
yêu c u.ầ
Ph l c 2:ụ ụ Danh sách các h s đ ngh công b c s s n xu t thu c đt tiêu chu n PIC/S - ồ ơ ề ị ố ơ ở ả ấ ố ạ ẩ
GMP và EU - GMP c n b sung gi i trình (Đt 68): Đ ngh doanh nghi p căn c n i dung c n ầ ổ ả ợ ề ị ệ ứ ộ ầ
b sung và gi i trình t i Ph l c 2 kèm theo công văn này đổ ả ạ ụ ụ ểg i công văn b sung và gi i trình ử ổ ả
v C c Qu n lý D c tr c ngày 08/11/2019. Nề ụ ả ượ ướ ếu quá th i gian trên, doanh nghi p không ti n ờ ệ ế
hành b sung gi i trình, h s đ ngh công b s x p lo i không đt yêu c u.ổ ả ồ ơ ề ị ố ẽ ế ạ ạ ầ
(Các Ph l c đc đăng t i trên trang thông tin đi n t c a C c Qu n lý D c - Đa ch : ụ ụ ượ ả ệ ử ủ ụ ả ượ ị ỉ
http://dav.gov.vn - M c Qu n lý giá thu c/TT v đu th u thu c)ụ ả ố ề ấ ầ ố
C c Qu n lý D c thông báo đ các doanh nghi p bi t và th c hi n./.ụ ả ượ ể ệ ế ự ệ
N i nh n:ơ ậ
- Như trên;
- C c tr ng Vũ Tu n C ng (đ b/c);ụ ưở ấ ườ ể
- Website C c Qu n lý D c;ụ ả ượ
- L u: VT, CL.ư
KT. C C TR NGỤ ƯỞ
PHÓ C C TR NGỤ ƯỞ
Đ Văn Đôngỗ
DANH SÁCH DOANH NGHI P CÓ H S Đ NGH CÔNG B PIC/S - GMP VÀ EU - GMPỆ Ồ Ơ Ề Ị Ố
KHÔNG ĐT, B SUNG GI I TRÌNHẠ Ổ Ả