
ĐỀ KIỂM TRA HKI MÔN: HÓA HỌC
Bài 1. (ĐH: 2 điểm; CĐ: 2,5 điểm)
1. Cho lá sắt kim loại vào:
* Dung dịch H2SO4 loãng
* Dung dịch H2SO4 loãng có một lượng nhỏ CuSO4
Nêu hiện tượng xảy ra, giải thích và viết các phương trình phản ứng trong mỗi trường
hợp.
Phương án nào trong các phương án sau đúng:
A. Khí H2 trong 2 trường hợp như nhau vì CuSO4 không ảnh hưởng gì
Fe + H2SO4= FeSO4 + H2
B. Khí H2 trong trường hợp không có mặt CuSO4 thoát ra mạnh hơn vì CuSO4 ngăn cản
H+ đi đến thanh sắt.
C. Khí H2 trong trường hợp có mặt CuSO4 thoát ra mạnh hơn vì có hiện tượng ăn mòn
hóa học
D. Khí H2 trong 2 trường hợp có mặt CuSO4 thoát ra mạnh hơn vì có ăn mòn điện hóa.
2. Trình bày phương pháp tách:
* Fe2O3 ra khỏi hỗn hợp Fe2O3, Al2O3, SiO2 ở dạng bột
* Ag ra khỏi hỗn hợp Ag, Cu, Fe ở dạng bột
Với mỗi trường hợp chỉ dùng duy nhất một dung dịch chứa một hóa chất và lượng oxit
hoặc kim loại cần tách vẫn giữ nguyên khối lượng ban đầu. Viết các phương trình phản
ứng và ghi rõ điều kiện.
Phương án nào trong các phương án sau đúng:
A. * Cho hỗn hợp tác dụng với dung dịch NaOH dư, đặc nóng lọc lấy Fe2O3
* Cho hỗn hợp tác dụng với HNO3 lấy dung dịch thu được tác dụng với HCl lọc lấy
kết tủa, đem điện phân nóng chảy.
B. * Cho hỗn hợp tác dụng với dung dịch Ca(OH)2 lọc lấy Fe2O3
* Cho hỗn hợp tác dụng với dung dịch FeCl2
C. * Cho hỗn hợp tác dụng với dung dịch Ca(OH)2 lọc lấy Fe2O3
* Cho hỗn hợp tác dụng với dung dịch FeCl3
D. * Cho hỗn hợp tác dụng với dung dịch NaOH dư, đặc nóng lọc lấy Fe2O3
* Cho hỗn hợp tác dụng với dung dịch FeCl3
Bài 2. (ĐH: 1 điểm; CĐ: 1,5 điểm)
Hỗn hợp A gồm BaO, FeO, Al2O3. Hòa tan A trong lượng dư nước, được dung dịch D và
phần không tan B. Sục khí CO2 dư vào D, phản ứng tạo kết tủa. Cho khí CO dư qua B
nung nóng được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần
còn lại chất rắn G. Hòa tan hết G trong lượng dư dung dịch H2SO4 loãng rồi cho dung
dịch thu được tác dụng với dung dịch KMnO4. Viết các phương trình phản ứng xảy ra
(Biết trong môi trường axit,
4
MnO bị khử thành Mn2+)
Phương án nào trong các phương án sau đúng:
D. Các phương án trên đều đúng
Bài 3. (ĐH: 1,5 điểm; CĐ: 1,5 điểm)

Hợp chất hữu cơ A1 mạch hở, không phân nhánh và chỉ chứa một loại nhóm chức, có
công thức phân tử C8H14O4. Cho A1 tác dụng với dung dịch NaOH thu được một rượu
duy nhất là CH3OH và một muối natri của axit hữu cơ B1.
* Viết công thức cấu tạo của A1. Gọi tên A1 và axit B1. Viết phương trình phản ứng
* Viết phương trình phản ứng điều chế tơ nilon-6,6 từ B1 và một chất hữu cơ thích hợp.
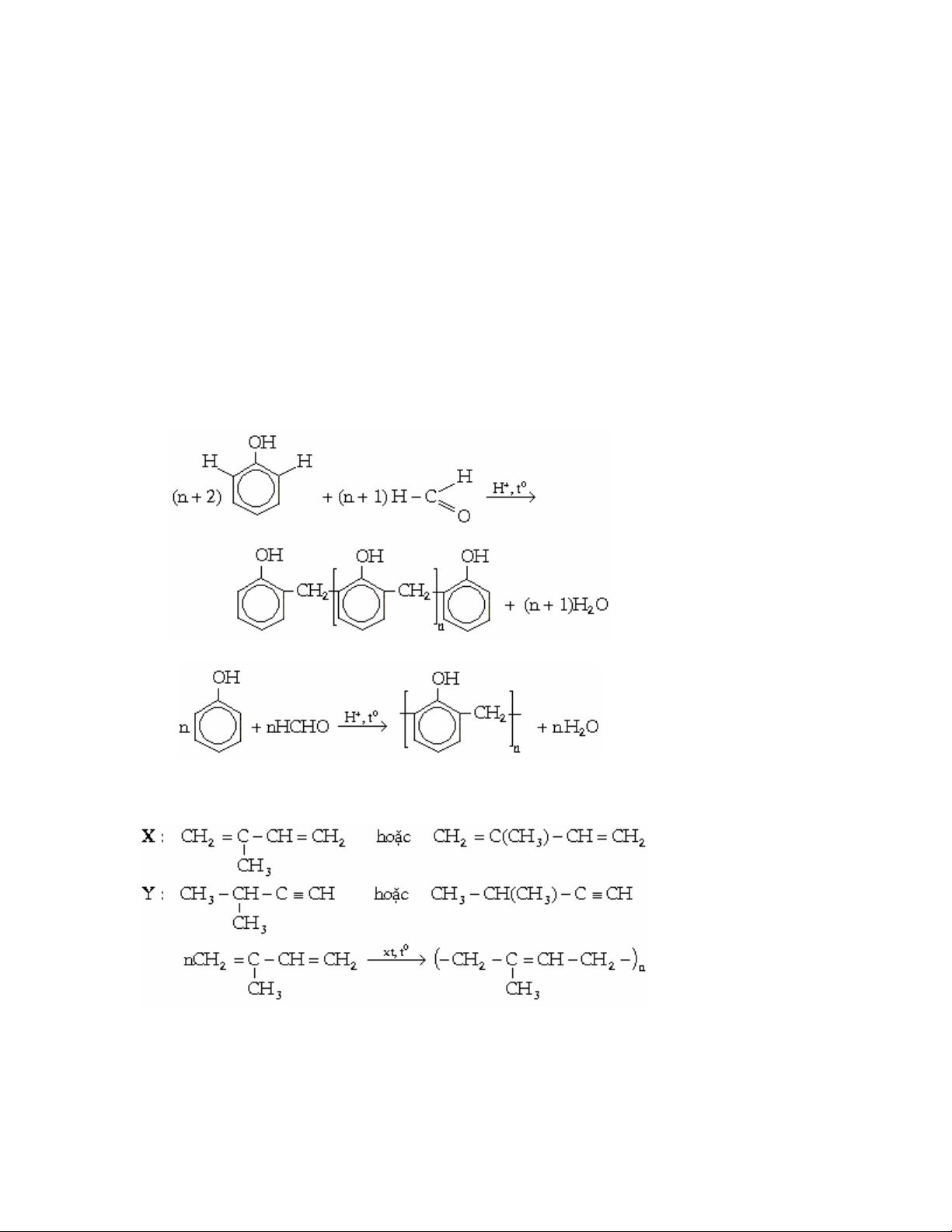
* Viết phương trình phản ứng điều chế nhựa phenolfomanđehit có cấu tạo mạch thẳng từ
rượu metylic, một chất hữu cơ thích hợp và các chất vô cơ cần thiết. Ghi rõ điều kiện
phản ứng.
Bài 4. (ĐH: 1,5 điểm; CĐ: 2 điểm)
* X và Y là hai hiđrocacbon có cùng công thức phân tử là C5H8. X là monome dùng để
trùng hợp thành cao su isopren; Y có mạch cacbon phân nhánh và tạo kết tủa khi cho
phản ứng với dung dịch NH3 và Ag2O. Hãy cho biết công thức cấu tạo của X và Y. Viết
các phương trình phản ứng xảy ra.
* Từ X, xenlulozơ, các chất vô cơ, xúc tác cần thiết, có thể điều chế chất hữu cơ M theo
sơ đồ phản ứng sau:
Cho biết D4 là một trong các sản phẩm của phản ứng cộng HCl vào các nguyên tử cacbon
ở vị trí 1,4 của X; D6 là 3-metylbutanol-1. Xác định công thức cấu tạo của các chất hữu
cơ D1, D2, D3, D4, D5, D6, M và viết các phương trình phản ứng hóa học xảy ra.
Bài 5. (ĐH: 2 điểm)
Cho 18,5 gam hỗn hợp Z gồm Fe, Fe3O4 tác dụng với 200 ml dung dịch HNO3 loãng đun
nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất
(đktc), dung dịch Z1 và còn lại 1,46 gam kim loại.
* Viết các phương trình phản ứng xảy ra.
* Tính nồng độ mol/l của dung dịch HNO3
* Tính khối lượng muối trong dung dịch Z1.
Bài 6. (ĐH: 2 điểm; CĐ: 2,5 điểm)
Hỗn hợp A gồm một axit no đơn chức và hai axit không no đơn chức chứa một liên kết
đôi, kế tiếp nhau trong dãy đồng đẳng. Cho A tác dụng hoàn toàn với 150 ml dung dịch
NaOH 2M. Để trung hoà vừa hết lượng NaOH dư cần thêm vào 100 ml dung dịch HCl
1M, được dung dịch D. Cô cạn cẩn thận D được 22,89 gam chất rắn khan. Mặt khác đốt
cháy hoàn toàn A rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng lượng dư
dung dịch NaOH đặc, khối lượng bình tăng thêm 26,72 gam. Xác định công thức cấu tạo
có thể có của từng axit và tính khối lượng của chúng trong hỗn hợp A.
Bài 1. (2 điểm)

1. (1 điểm)
a) Lúc đầu xuất hiện bọt khí thoát ra từ lá sắt, sắt tan dần. Sau đó khí thoát ra chậm dần,
do bọt khí bám trên bề mặt lá sắt ngăn sự tiếp xúc của sắt với dung dịch H2SO4.
2442 HFeSOSOHFe
b) Lúc đầu bề mặt lá sắt có kim loại màu đỏ bám vào, sau đó khí thoát ra nhanh hơn,
sắt bị hòa tan nhanh do có sự ăn mòn điện hóa
CuFeSOCuSOFe 44
Trong dung dịch H2SO4, lá sắt kim loại là cực âm, kim loại đồng là cực dương. Tại cực
âm, sắt kim loại bị oxi hóa:
Fe 2e Fe2+.
Tại cực dương, ion H+ bị khử: 2H+ + 2e H2.
2. (1 điểm)
a) Cho hỗn hợp tác dụng với dung dịch NaOH đặc, nóng, Fe2O3 không tan, lọc, tách ta
được Fe2O3, Al2O3 và SiO2 tan do phản ứng:
OHSiONaNaOH2SiO
OHNaAlO2NaOH2OAl
2322
2232
b) Cho hỗn hợp tác dụng với dung dịch muối sắt (III) dư như FeCl3, Fe2(SO4)3..., Ag
không phản ứng, lọc tách được bạc. Kim loại đồng và sắt tan do phản ứng :
23
223
FeCl3FeCl2Fe
CuClFeCl2FeCl2Cu
Bài 2. (1 điểm)
Hoà tan hỗn hợp A vào lượng dư nước có các phản ứng:
OH)AlO(BaOAl)OH(Ba
)OH(BaOHBaO
222322
22
Dung dịch D là Ba(AlO2)2
Phần không tan B: FeO và Al2O3 còn dư (Do E tan một phần trong dung dịch NaOH)
Sục khí CO2 dư vào D:
2332222 )HCO(Ba)OH(Al2OH4CO2)AlO(Ba
Cho khí CO dư qua B nung nóng có phản ứng sau:
2
COFeCOFeO
Chất rắn E: Fe và Al2O3.
Cho E tác dụng với dung dịch NaOH dư:
OHNaAlO2NaOH2OAl 2232
Chất rắn G: Fe
Cho G tác dụng với dung dịch H2SO4
2442 HFeSOSOHFe
và dung dịch thu được tác dụng với dung dịch KMnO4
OH8SOK)SO(Fe5MnSO2SOH8FeSO10KMnO2 24234244244
Bài 3. (1,5 điểm)
1.
34231 COOCH)CH(OOCCH:A
Đimetyl ađipat (Đimetyl hexanoat)
COOH)CH(HOOC:B 421
Axit ađipic (axit hexanđioic)
COONa)CH(NaOOCOHCH2
NaOH2COOCH)CH(OOCCH
423
t
3423
0
2. Phương trình điều chế tơ nilon:
OnH2)NH)CH(NHCO)CH(CO(
HNH)CH(NHHnCOOH)CH(HOOCn
2n6242
t
6242
0
3. Điều chế nhựa phenolfomanđehit
CuOHHCHOCuOOHCH 2
t
3
0
Hoặc
Bài 4. (1,5 điểm)
1.
Hoặc:
OHCAgC)CH(CHCH2OAgCHC)CH(CHCH
CHCH)CH(CCHCHCH)CH(CnCH
233
NH
233
n
232
xt,t
232
3
0
2.

OHCOOHCHOOHHC
CO2OHHC2OHC
OHnCOnHOHC
23
giÊmmen
252
252
giÊmmen
6126
6126
H
2
n
5106
Bài 5. (2 điểm)
Cách 1.
Gọi số mol Fe tham gia phản ứng với HNO3 ở (1) là x, số mol Fe3O4 tham gia phản ứng
với HNO3 ở (2) là y.
2
33
2
3
3
332
3
3
3
28
2149283
4
124
2333
233343
2333
)yx(yx
yx
)()NO(FeFe)NO(Fe
y
y
y.
y
)(OHNO)NO(FeHNOOFe
xxxx
)(OHNO)NO(FeHNOFe
Phản ứng xảy ra hoàn toàn và sau cùng còn dư kim loại nên HNO3 đã phản ứng hết. Do
xảy ra phản ứng (3) nên dung dịch Z1 là dung dịch Fe(NO3)2.
2
3
3yx
lµ)(ëøngn¶phFemolSè


![Đề kiểm tra HKI Hóa học: Tổng hợp [mới nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111102/portsmouth6811/135x160/de_kiem_tra_hoc_ki_hoa_12_6026.jpg)
![Đề thi cuối kỳ I: Tổng hợp [môn học/năm học] tốt nhất](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111026/tottenham6811/135x160/de_ltdh_rat_chuan_so_11_4939.jpg)
![Tổng hợp 7 Đề thi HK1 môn Hóa 12 [có đáp án]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111024/everton6811/135x160/tuyen_tap_cac_de_on_thi_cuc_hay_mon_hoa_4054.jpg)


![Đề kiểm tra hoá học học kỳ I khối 12: [Kinh nghiệm/Mới nhất/Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111019/barcelona6811/135x160/de_thi_7337.jpg)




![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








