SỞ GD-ĐT VĨNH LONG KỲ THI HỌC SINH GIỎI ĐỒNG BẰNG SÔNG CỬU LONG
ĐỀ THI MÔN HÓA HỌC – ĐỀ A
Thời gian làm bài:180 phút
------------------------------
Câu I: (4điểm)
Brôm lỏng tác dụng với H3PO3 theo phản ứng:
H3PO3 + Br2 +H2O
€
H3PO4 + 2H+ + 2Br -
1.Tính hằng số cân bằng của phản ứng ở 298oK.
2.Tính thế điện cực chuẩn Eo(H3PO4/H3PO3) nếu biết Eo(Br2/2Br - ) =1,087 V.
3. Viết phương trình nửa phản ứng oxy hoá-khử của các cặp H3PO3 /H3PO2, H3PO4/H3PO2.
Tính thế điện cực chuẩn Eo(H3PO3 /H3PO2) nếu biết Eo(H3PO4/H3PO2)= - 0,39 V.
Cho biết các số liệu sau ở 298oK:
H+(dd) H3PO4(dd) Br –(dd) H3PO3(dd) Br2(l) H2O(l)
o
H
(kJ/mol) 0 -1308 -141 -965 0 -286
o
S
(J/mol.K) 0 -108 83 167 152 70
Câu 2( 4 điểm)
1. Cho dung dịch Mg2+ 0,01M. Tính pH để :
a) Bắt đầu kết tủa Mg(OH)2.
b) Kết tủa hoàn toàn Mg(OH)2, biết rằng Mg(OH)2 được coi là kết tùa hoàn toàn khi nồng độ ion Mg2+ sau
khi kết tùa chỉ bằng 0,01% so với lượng ban đầu có trong dung dịch.
2
10
( )
6.10
Mg OH
T
2.Trộn x lit dung dịch axit mạnh (HA) có pH = 4. Với y lit dung dịch bazơ mạnh (BOH) có pH = 9.
Tính tỉ lệ x : y để thu được dung dịch có pH = 6?
Câu 3 (4 điểm)
1- Anken (A) C6H12 có đồng phân hình học, tác dụng với dd Br2 cho hợp chất đibrom B, B tác dụng với KOH
trong ancol đun nóng cho đien C và 1 ankin C’, C bị oxi hóa bởi KMnO4 đđ/t0 cho axit axetic và khí CO2. Hãy lập
luận để xác định cấu tạo của A và viết phương trình phản ứng:
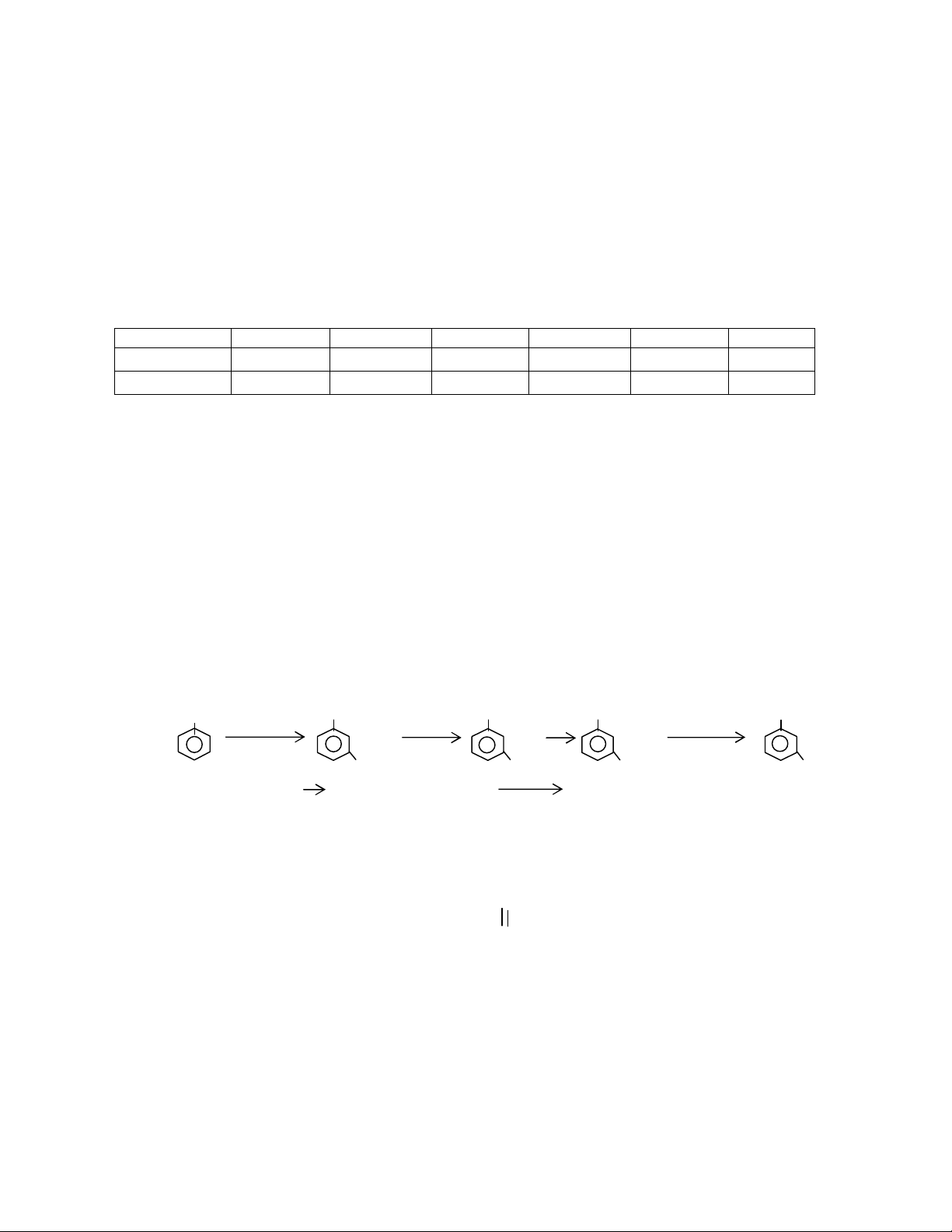
2- Hoàn chỉnh các sơ đồ phản ứng sau và viết các phương trình phản úng xảy ra:
3/ Cho sơ đồ tổng hợp sau:
a/
b/ Br-CH2-CH2-Br MgBr-CH2-CH2-MgBr HO-(CH2)4-OH
Hãy chỉ rõ (có phân tích) những chỗ sai trong hai sơ đồ trên.
Câu 4 (4 điểm)
1.Từ một loại tinh dầu người ta tách được chất A. Kết quả phân tích cho thấy A chứa 78,95% C; 10,52%H,
còn lại là oxi. Tỉ khối hơi của A so với H2 là 76. A phản ứng với dung dịch AgNO3/ ddNH3 cho kết tủa Ag và muối
của axit hữu cơ, khi bị oxy hóa mạnh thì A cho một hỗn hợp sản phẩm gồm axeton, axit oxalic và axit lenilic (
CH3 CH2CH2COOH).
O
Biết rằng A tác dụng với Br2 (trong CCl4) theo tỉ lệ mol 1:1 chỉ thu được 2 dẫn xuất đibrom. Tìm công thức
cấu tạo của A.Viết các phương trình hóa học của A với dd AgNO3/dd NH3 và với Br2 (trong CCl4).
2. Axit tropoic C9H10O3 (B) bị oxy hóa bởi dd KMnO4 nóng thành axit benzoic, bị oxy hóa bởi oxy không khí
có mặt Cu nung nóng thành C9H8O3 (C) có chức andehit. B có thể chuyển hóa thành axit atropoic C9H8O2 (D) nhờ
H2SO4 đặc ở 170oC. Hidro hóa D bằng H2/Ni thu được axit hydratropoic C9H10O2 (E).
Hãy xác định công thức cấu tạo của B,C,D,E.
Câu 5 (4 điểm)
1. a) Có 2 lọ đựng 2 chất lỏng riêng biệt không nhãn: H2O; H2O2. Nêu cách phân biệt 2 lọ đựng 2 chất lỏng
trên và viết phương trình phản ứng.
b) Giải thích tại sao 2 phân tử NO2 có thể kết hợp tạo ra N2O4 ?
NO
2
CH3COCl/AlCl3
(1)
NO2
COCH3
Zn/Hg
HCl
(2) NO2
CH2CH2Cl
NO2
CH=CH2
NO2
CH2CH3
Cl2
(3)
KOH/C2H5OH
(4)
Mg HCHO
(2)
3 32
/ ,
Propen ( pentan)
O PBr
Zn H O NaOH NaOH HCHO Zn
A B C D E F G spiro
















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








