
SỞ GD & ĐT VĨNH PHÚC
ĐỀ CHÍNH THỨC
KỲ THI CHỌN HỌC SINH GIỎI LỚP 11 NĂM HỌC 2011-2012
ĐỀ THI MÔN: HOÁ HỌC
(Dành cho học sinh THPT)
(Thời gian làm bài: 180 phút, không kể thời gian giao đề)
Bài 1 (1,5 điểm ).
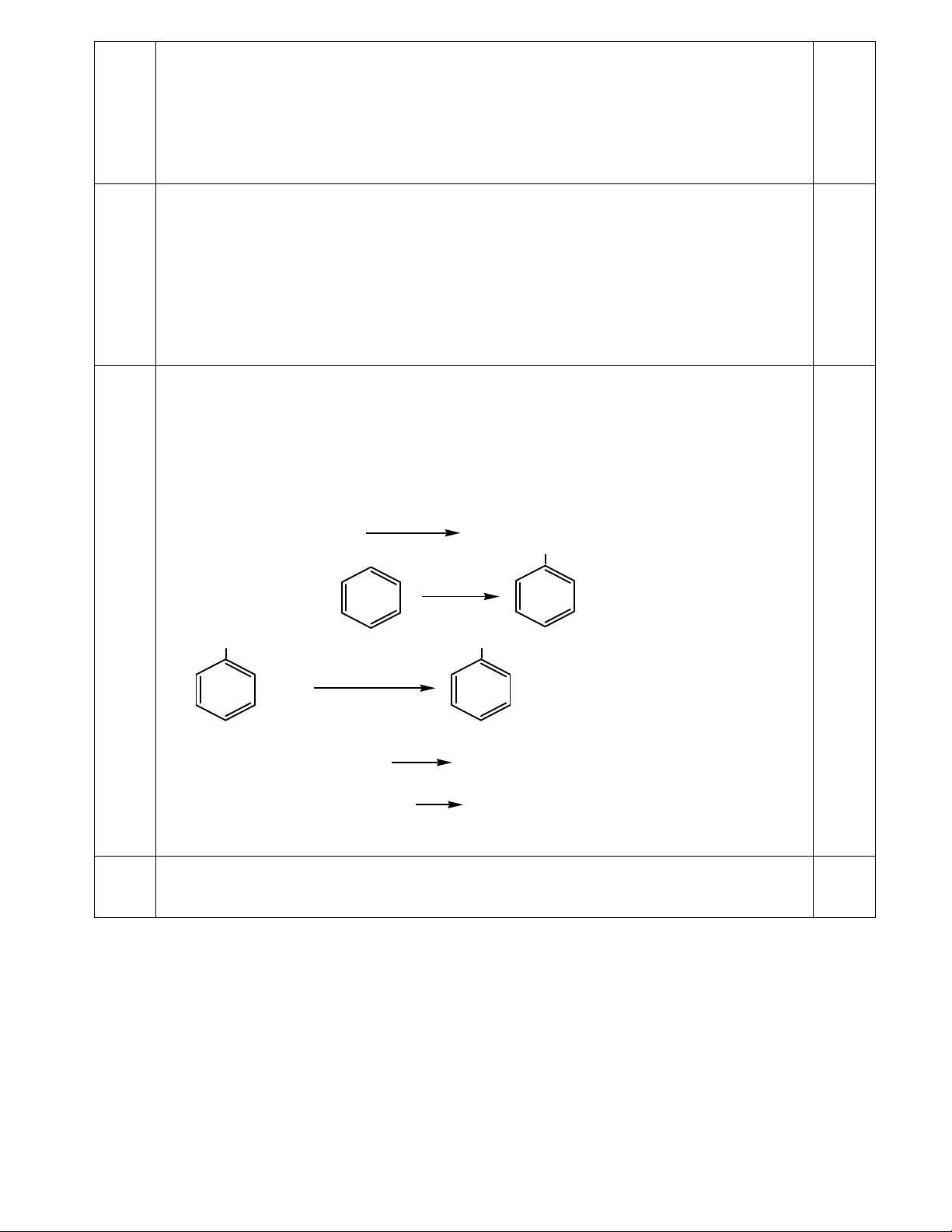
Thổi 672 ml (đktc) hỗn hợp khí A gồm một ankan, một anken và một ankin (đều có số nguyên tử cacbon
trong phân tử bằng nhau) qua lượng dư dung dịch AgNO3/NH3, thì thấy có 3,4 gam AgNO3 đã tham gia
phản ứng. Cũng lượng hỗn hợp khí A như trên làm mất màu vừa hết 200 ml dung dịch Br2 0,15 M.
1) Xác định công thức cấu tạo và tính khối lượng mỗi chất trong A.
2) Đề nghị phương pháp tách riêng từng chất ra khỏi hỗn hợp A.
Bài 2. (1,5 điểm).
Hòa tan hoàn toàn 26,4 gam hỗn hợp A gồm Fe và Cu trong dung dịch HNO3, thu được 7,84 lít NO (đktc)
và 800 ml dung dịch X. Cho từ từ dung dịch HCl vào X đến khi không còn khí thoát ra, thì thu được thêm
1,12 lít NO (đktc).
1) Xác định % khối lượng của mỗi kim loại trong A.
2) Tính số mol HNO3 đã tham gia phản ứng.
3) Tính CM của các chất trong X.
Bài 3 (1,5 điểm).
Thủy phân hoàn toàn 2,475 gam halogenua của photpho người ta thu được hỗn hợp 2 axit (axit của
photpho với số oxi hóa tương ứng và axit không chứa oxi của halogen). Để trung hòa hoàn toàn hỗn hợp
này cần dùng 45 ml dung dịch NaOH 2M. Xác định công thức của halogenua đó.
Bài 4 (2,0 điểm).
1.Chỉ dùng chất chỉ thị phenolphtalein, hãy phân biệt các dung dịch riêng biệt NaHSO4, Na2CO3, AlCl3,
Fe(NO3)3, NaCl, Ca(NO3)2. Viết các phản ứng minh họa dưới dạng ion thu gọn.
2. Cho các sơ đồ phản ứng sau:
a) X + O2
… + H2O
b) X + CuO
N2 + … + …
c) X + H2S
…
d) X + CO2
… + H2O
e) X + H2O + CO2
…
Tìm công thức của khí X và hoàn thành các phương trình hoá học trên.
Bài 5 (1,5 điểm).
Hòa tan 4,8 gam kim loại M hoặc hòa tan 2,4 gam muối sunfua của kim loại này, bằng dung dịch HNO3
đặc nóng dư, thì đều thu được lượng khí NO2 (sản phẩm khử duy nhất) như nhau.
1) Viết các phương trình phản ứng xẩy ra.
2) Xác định kim loại M, công thức phân tử muối sunfua.
3) Hấp thụ khí sinh ra ở cả hai phản ứng trên vào 300 ml dung dịch NaOH 1M, rồi thêm vào đó một ít
phenolphtalein. Hỏi dung dịch thu được có màu gì? Tại sao?
Bài 6. (1,0 điểm).
Hỗn hợp A gồm 2 ankan là đồng đẳng kế tiếp và 1 anken, trong đó có 2 chất có cùng số nguyên tử cacbon.
Đốt cháy một lượng A thu được 6,72 lít CO2 (đktc) và 8,1 gam H2O. Xác định công thức phân tử của 3
hiđrocacbon trong A.
Bài 7 (1,0 điểm). Tìm các chất thích hợp ứng với các ký hiệu A1, A2, A3, A4, A5 trong sơ đồ sau và hoàn
thành các phương trình phản ứng dưới dạng công thức cấu tạo?
CnH2n+2
A1(khí)
Crackinh A2
A3
A4
(C3H6O)A5
+Benzen/H+
+H2O/H++O2/xt
+O2,xt
(1)
(2) (3)
(5)
(4)
-------Hết------
Họ và tên thí sinh .............................................................................Số báo danh ..........................................
(Giám thị coi thi không giải thích gì thêm)

SỞ GD & ĐT VĨNH PHÚC
KỲ THI CHỌN HỌC SINH GIỎI LỚP 11 NĂM HỌC 2011-2012
HƯỚNG DẪN CHẤM MÔN: HOÁ HỌC
(Dành cho học sinh THPT )
Bài 1
1,5 đ
(1) Nếu ankin có dạng RC
CH :
RCCH + AgNO3 + NH3 RCCAg + NH4NO3
mol02,0
mol/gam170
gam4,3
)ankin(n và mol04,0)ankin(n2n 2
Br
Điều này trái giả thiết, vì số mol Br2 chỉ bằng mol03,0L/mol15,0L2,0
Vậy ankin phải là C2H2 và như vậy ankan là C2H6, anken là C2H4.
Từ phản ứng :
C2H2 + 2AgNO3 + 2NH3 C2Ag2 + 2NH4NO3
n(C2H2) = 1/2n(AgNO3) = 0,01 mol
Từ các phản ứng :
C2H2 + 2Br2 C2H2Br4
C2H4 + Br2 C2H4Br2
n(C2H4) = 0,01 mol
n(C2H6) = mol01,0mol01,0
mol/L4,22
L672,0 0,01 mol.
Khối lượng của: C2H2: 0,26gam; C2H4: 0,28 gam; C2H6: 0,3 gam.
(2)Thổi hỗn hợp qua binh chứa dung dịch AgNO3/NH3 dư. Lọc tách kết tủa, hòa tan kết tủa
trong dung dịch HCl dư thu được khí C2H2.
C2H2 + 2AgNO3 + 2NH3 C2Ag2 ↓ + 2NH4NO3
C2Ag2 + 2HCl C2H2 + 2AgCl ↓
Khí ra khỏi bình chứa dung dịch AgNO3/NH3, thổi tiếp qua dung dịch nước brom dư.
Chiết lấy sản phẩm và đun nóng với bột Zn (trong CH3COOH) thu được C2H4 :
C2H4 + Br2 C2H4Br2
C2H4Br2 + Zn C2H4 + ZnBr2
Khí ra khỏi bình chứa dung dịch brom là khí C
2
H
6
0,5
0,5
0,25
0,25
Bài 2.
1,5đ
1) X + HCl
NO
=> trong X còn muối Fe(NO3)2
(1)
7,84
0,35( )
22,4
NO
n mol
; (2)
1,12
0,05( )
22,4
NO
n mol
Sau khi cho HCl vào X thì thu được dung dịch trong đó chứa: Cu2+ và Fe3+
Gọi x, y lần lượt là số mol của Fe và Cu
Ta có:
56x+64y=26,4 0,3
3x+2y= 3(0,35+0,05) 0,15
x
y
=> 0,3.56
% e= .100% 63,64%
26,4
F; %Cu = 100% - %Fe = 36,36%
2) Số mol HNO3 than gia phản ứng = 4nNO(1) = 0,35.4 = 1,4(mol)
3) Gọi a , b lần lượt là số mol Fe(NO3)2 và Fe(NO3)3 trong X
=> a + b = 0,3
2a + 3b + 2. 0,15 = 3.0,35
=> a = 0,15 (mol); b = 0,15 (mol)
=> trong X có : 0,15 mol Fe(NO3)2; 0,15 (mol) Fe(NO3)3 và 0,15 mol Cu(NO3)2
=> CM các chất đều bằng nhau và bằng: 0,15
0,1875
0,8
M
0,25
0,5
0,25
0,5

Bài 3
1,5đ
Halogenua của photpho có thể có công thức PX3 hoặc PX5.
*Xét trường hợp PX3:
PTHH PX3 + 3H2O → H3PO3 + 3HX
H3PO3 + 2NaOH → Na2HPO3 + 2H2O ( axit H3PO3 là axit hai lần axit)
HX + NaOH → NaX + H2O
số mol NaOH = 2. 0,045 = 0,09 mol
Để trung hòa hoàn toàn sản phẩm thủy phân 1 mol PX3 cần 5 mol NaOH;
số mol PX3 = 1/5 số mol NaOH = 0,09/5 = 0,018 mol
Khối lượng mol phân tử PX3 = 2,475/0,018 = 137,5
Khối lượng mol cuả X = (137,5 – 31): 3 = 35,5 X là Cl . Công thức PCl3
*Xét trường hợp PX5:
PX5 + 4H2O → H3PO4 + 5HX
H3PO4 + 3NaOH → Na3PO4 + 3H2O
HX + NaOH → NaX + H2O
số mol NaOH = 2. 0,045 = 0,09 mol
Để trung hòa hoàn toàn sản phẩm thủy phân 1 mol PX5 cần 8 mol NaOH;
số mol PX5 = 1/8 số mol NaOH = 0,09/8 = 0,01125 mol
Khối lượng mol phân tử PX5 = 2,475/0,01125 = 220
Khối lượng mol cuả X = (220 – 31): 5 = 37,8 không ứng với halogen nào.
0,5
0,5
0,25
0,25
Bài 4
2,0đ
1.
Trích mẫu thử cho mỗi lần thí nghiệm:
Cho phenolphtalein vào mỗi mẫu thử. Mẫu thử có màu hồng là dung dịch Na2CO3,
các mẫu thử còn lại không màu.
CO32- + H2O
HCO3- + OH-
Dùng Na2CO3 làm thuốc thử để cho vào các mẫu thử còn lại.
Mẫu thử có sủi bọt khí không màu là NaHSO4
CO32- + 2H+ H2O + CO2↑
Mẫu thử tạo kết tủa trắng keo và sủi bọt khí không màu là AlCl3
2Al3+ + 3CO32- + 3H2O 2Al(OH)3↓+ 3CO2↑
Mẫu thử tạo kết tủa đỏ nâu và sủi bọt khí không màu là Fe(NO3)3
2Fe3+ + 3CO32- + 3H2O 2Fe(OH)3↓+ 3CO2↑
Mẫu thử tạo kết tủa trắng là Ca(NO3)2
Ca2+ + CO32- CaCO3↓
Mẫu thử không tạo hiện tượng là NaCl.
2. Qua sơ đồ a), b) X có chứa N và H, có thể có O. Vì X là chất khí nên chỉ có thể là NH3.
a) 4NH3 + 3O2 2N2 + 6H2O
hoặc 4NH3 + 5O2 4NO + 6H2O ( có xúc tác Pt)
b) 2NH3 + 3CuO N2 + 3Cu + 3H2O
c) 2NH3 + H2S (NH4)2S
hoặc NH3 + H2S NH4HS
d) 2NH3 + CO2 (NH2)2CO + H2O
e) NH
3
+ H
2
O + CO
2
NH
4
HCO
3
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
Bài 5
1,5đ
(1) Phương trình phản ứng:
M + 2mH+ + mNO3- Mm+ + mNO2 + mH2O (1)
M2Sn + 4(m+n)H+ + (2m+6n)NO3- 2Mm+ + nSO42- + (2m+6n)NO2 + 2(m+n)H2O (2)
(2) Vì số mol NO2 ở hai trường hợp là bằng nhau nên ta có:
)n6m2(
n
32
M
2
4,2
m
M
8,4
3,2,1m,n m2n6
mn64
M, nghiệm thích hợp là n = 1, m = 2 và M = 64.
Vậy M là Cu và công thức muối là Cu2S.
(3) mol075,0
64
8,4
nCu
0,5
0,5
Cu + 4HNO3
Cu(NO3)2 + 2NO2 + 2H2O
NaOHNO nmol3,0075,022n 2
đã xảy ra vừa đủ phản ứng:
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
Dung dịch thu được có màu hồng do NO2- tạo môi trường bazơ:
NO2- + H2O ⇌ HNO2 + OH-
0,25
0,25
Bài 6.
1,0 đ
Gọi công thức của ankan là CnH2n+2 x (mol) và anken CmH2m y (mol)
Ta có :
Số mol CO2 = 0,3 (mol)
Số mol H2O = 0,45 (mol)
số mol ankan = 0,45 – 0,3 = 0,15 (mol)
0,15.n + ym = 0,3
n <2
2 ankan là CH4 và C2H6
Trong A có 2 chất cùng số nguyên tử cacbon => anken C
2
H
4
0,25
0,5
0,25
Bài 7
1,0đ
* Các chất cần tìm:
A1: CH3-CH2-CH2-CH3
A2: CH3- CH=CH2
A3: C6H5-CH(CH3)2 (Cumen)
A4: CH3-CH(OH)-CH3
A5: CH3-CO-CH3
* Các phản ứng:
CH3-CH2-CH2-CH3
Crackinh +CH4
+H2SO4
CH(CH3)2
CH(CH3)21.O2
2.H2SO4(l)
OH
+ CH3-CO-CH3
+
CH3-CH=CH2H2OH+
CH3-CH(OH)-CH3
CH3-CH(OH)-CH3+ 1/2O2
Cu,t0CH3-CO-CH3+ H2O
1.
2.
3.
4.
5.
CH3-CH=CH2
CH3-CH=CH2
(A1) (A2)
(A3)
(A5)
(A4)
(A5)
0,25
0,25
0,25
0,25
Ghi chú:
Khi chấm nếu học sinh giải theo các phương pháp khác, nếu đúng vẫn cho đủ số điểm.
Trong một bài thí sinh làm đúng đến phần nào thì tính điểm đến phần đó theo thang điểm.

1
SỞ GD&ĐT VĨNH PHÚC
-----------------------
ĐỀ CHÍNH THỨC
KÌ THI CHỌN HSG LỚP 11 THPT NĂM HỌC 2011-2012
ĐỀ THI MÔN: LỊCH SỬ
Dành cho học sinh trường THPT
Thời gian làm bài: 180 phút, không kể thời gian giao đề
-------------------------
Câu 1 (2,5 điểm)
Lập bảng so sánh giữa cuộc Chiến tranh thế giới thứ nhất (1914-1918) với cuộc
Chiến tranh thế giới thứ hai (1939-1945) theo mẫu sau:
Nội dung so sánh Chiến tranh thế giới thứ nhất
Chiến tranh thế giới thứ hai
Nguyên nhân
Tính chất
Kết cục
Câu 2 (1,5 điểm)
Phân tích những tiền đề dẫn tới sự bùng nổ của cuộc Cách mạng tháng Mười Nga
năm 1917.
Câu 3 (1,5 điểm)
Khái quát về cao trào cách mạng 1918-1923 ở các nước tư bản châu Âu. Sự ra
đời và hoạt động của Quốc tế Cộng sản (1919-1943) có ảnh hưởng như thế nào đối với
phong trào cách mạng thế giới?
Câu 4 (1,5 điểm)
Những nét chính về phong trào chống Pháp của nhân dân Lào và Cam-pu-chia
giữa hai cuộc chiến tranh thế giới (1918-1939)?
Câu 5 (3,0 điểm)
Cuộc kháng chiến chống thực dân Pháp xâm lược của quân dân ta ở Bắc Kì đã
diễn ra như thế nào trong những năm 1873-1883? Tại sao cuộc kháng chiến chống thực
dân Pháp xâm lược của quân dân ta cuối thế kỉ XIX chưa giành được thắng lợi?
-------------Hết--------------
Cán bộ coi thi không giải thích gì thêm
Họ và tên thí sinh………………………………….Số báo danh………………



![Đề thi học sinh giỏi Quốc gia THPT môn Hoá học năm 2021-2022 có đáp án [Kèm đề thi]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230215/bapnuong09/135x160/2931676452944.jpg)








![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








