
S GIÁO D C - ĐÀO T OỞ Ụ Ạ
THÁI BÌNH
Đ THI TUY N SINH VÀO L P 10 THPT CHUYÊN THÁI BÌNHỀ Ể Ớ
Năm h c 2009-2010ọ
MÔN THI: ho¸ häc
Th i gian làm bài: 120 phútờ (không k th i gian giao để ờ ề
H c sinh đ c s d ng b ng h th ng tu n họ ượ ử ụ ả ệ ố ầ oàn
Câu 1: (2,0 đi m)ể
1. Nêu hi n t ng, vi t các ph ng trình ph n ng (n u có) khi ti n hành các thí nghi m sau:ệ ượ ế ươ ả ứ ế ế ệ
a. Cho m u Natri vào dung d ch CuSOẩ ị 4.
b. Cho m u đá vôi vào dung d ch NaHSOẩ ị 4.
c. Cho canxi cacbua vào dung d ch axit HCl.ị
d. Cho lòng tr ng tr ng vào r u etylic.ắ ứ ượ
e. Cho dung d ch glucoz vào dung d ch Agị ơ ị 2O/NH3, đun nóng nh .ẹ
2. Đ t cháy hoàn toàn m gam m t phi kim X trong mố ộ 1 gam oxi thu đ c h n h p khí g m XOượ ỗ ợ ồ 2 và O2 có tỉ
kh i so v i không khí (ố ớ
kk
M
= 29) là 1,7655. Tính t l m/mỉ ệ 1?
Câu 2: (2,0 đi m)ể
1. Tính kh i l ng tinh b t c n dùng đ lên men t o thành 5 lít r u etylic 46ố ượ ộ ầ ể ạ ượ 0. Bi t r ng hi u su t toàn quáế ằ ệ ấ
trình là 72%, kh i l ng riêng c a r u etylic nguyên ch t là 0,8g/ml; c a n c nguyên ch t là 1g/ml.ố ượ ủ ượ ấ ủ ướ ấ
2. L y 500ml r u đi u ch đ c trên lên men gi m (hi u su t ph n ng 75%) thu đ c dung d ch A.ấ ượ ề ế ượ ở ấ ệ ấ ả ứ ượ ị
Cho toàn b dung d ch A tác d ng v i natri d th y gi i phóng V lít Hộ ị ụ ớ ư ấ ả 2 (đktc). Tính V?
Câu 3: (2,0 đi m)ể
S c t t a mol khí COụ ừ ừ 2 vào 800ml dung d ch A g m KOH 0,5M và Ca(OH)ị ồ 2 0,2M
a. V đ th bi u di n m i quan h gi a s mol k t t a và s mol khí COẽ ồ ị ể ễ ố ệ ữ ố ế ủ ố 2.
b. Tính giá tr c a a đ thu đ c kh i l ng k t t a l n nh t.ị ủ ể ượ ố ượ ế ủ ớ ấ
c. Tính giá tr c a a đ kh i l ng k t t a thu đ c là 10 gam.ị ủ ể ố ượ ế ủ ượ
d. Tính kh i l ng k t t a thu đ c khi giá tr c a a là 0,6.ố ượ ế ủ ượ ị ủ
Câu 4: (2,0 đi m)ể
Cho h n h p khí D g m Hỗ ợ ồ 2; CnH2n+2; CnH2n-2. Đ t cháy hoàn toàn 100cmố3 D thu đ c 210cmượ 3 CO2. M t khác, khiặ
cho 100cm3 D đi qua b t Ni nung nóng thì thu đ c 70cmộ ượ 3 m t hiđrocacbon E duy nh t. ộ ấ
a. Xác đ nh công th c phân t c a các hiđrocacbon trong D. ị ứ ử ủ
b. Tính th tích khí Oể2 c n dùng đ đ t cháy h t 100cmầ ể ố ế 3 D.
Bi t các khí đo cùng đi u ki n, các ph n ng x y ra hoàn toàn.ế ở ề ệ ả ứ ả
Câu 5: (2,0 đi m)ể
H n h p b t X g m nhôm và kim lo i ki m M. Hoà tan hoàn toàn 3,18 gam X trong l ng v a đ dung d chỗ ợ ộ ồ ạ ề ượ ừ ủ ị
axit H2SO4 loãng thu đ c 2,464 lít Hượ 2 (đktc) và dung d ch Y (ch g m mu i sunfat trung hoà). Cho Y tác d ng v iị ỉ ồ ố ụ ớ
l ng v a đ dung d ch Ba(OH)ượ ừ ủ ị 2 cho t i khi g c sunfat chuy n h t thành k t t a thì thu đ c 27,19 gam k t t a.ớ ố ể ế ế ủ ượ ế ủ
a. Xác đ nh kim lo i M.ị ạ
b. Cho thêm 1,74 gam mu i Mố2SO4 vào dung d ch Y thu đ c dung d ch Z. Ti n hành k t tinh c n th nị ượ ị ế ế ẩ ậ
dung d ch Z thu đ c 28,44g tinh th mu i kép. Xác đ nh công th c c a tinh th ?ị ượ ể ố ị ứ ủ ể
(-C6H10O5-)n + nH2O
→
ctaxit
o
,
nC6H12O6 (1) C6H12O6
→
−)3230(,
0
Cmenruou
2C2H5OH + 2CO2 (2)
Tõ (1) vµ (2) cã biÕn ho¸ sau: (-C6H10O5-)n
→
2nC2H5OH
162n Kg
→
2n.46Kg
Câu 1 : 1a. Cã khÝ tho¸t ra, mµu xanh dung dÞch nh¹t dÇn, cã kÕt tña xanh xuÊt hiÖn:
Na + H2O
→
NaOH + 1/2H2 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
b. Dung dÞch vÈn ®ôc, cã bät khÝ xuÊt hiÖn: CaCO3 + 2NaHSO4 → CaSO4 + Na2SO4 + H2O + CO2
c. Cã bät khÝ tho¸t ra: CaC2 + 2HCl → CaCl2 + C2H2
d. Cã hiÖn tîng ®«ng tô protein (kÕt tña tr¾ng næi trªn bÒ mÆt)
e. Cã kÕt tña s¸ng b¹c xuÊt hiÖn C6H12O6 + Ag2O
→
ct,NH
0
3
C6H12O7 + 2Ag
2: X + O2
→
ct
o
XO2
Sau ph¶n øng cã:
2,5129.7655,1
==
sau
M
msau = mtríc =
1OX mmmm 2
+=+
nsau =
2
O
n
d +
2
XO
n
=
2
O
n
ban ®Çu = m1/32
Theo bµi cã:
2,51
32
1
1=
+
=m
mm
M
⇔
6,1
32
2,51
1
1
==
+
m
mm
→
6,0
1
=
m
m
Đ CHÍNH TH CỀ Ứ
Câu 2: 1.
KgmlitV OHHCOHHC 84,18,0.3,23,2
100
46.5
5252
==→==
3,24Kg
←
1,84Kg
mtinh bét thùc tÕ = 3,24.100/72 = 4,5Kg
2. TÝnh t¬ng tù trªn trong 500ml rîu etylic 460 cã:
mrîu = 184g
→
nrîu = 184/46 = 4mol Vníc = mníc = 500 – 230 = 270 g
→
nH2O = 270/18 = 15mol
nrîu ph¶n øng = 4.75/100 = 3mol
Ph¶n øng lªn men: C2H5OH + O2
→
mengiam
CH3COOH + H2O (3)
3mol 3mol 3mol
Sau ph¶n øng trong A cã: C2H5OH d lµ 4 – 3 = 1mol
CH3COOH lµ 3mol
H2O lµ 15 + 3 = 18mol
Cho A t¸c dông víi Na:
CH3COOH + Na
→
CH3COONa + 1/2H2 (4)H2O + Na
→
NaOH + 1/2 H2 (5)
C2H5OH + Na
→
C2H5ONa + 1/2 H2 (6)
Theo ph¬ng tr×nh 4; 5 vµ 6 cã:
mol11)1183.(2/1)nnn.(2/1n OHHCOHCOOHCHH 52232
=++=++=
2
H
V
= 11.22,4 = 246,4lÝt
Câu 3: a. §æi 800 ml = 0,8 lÝt
KOH
n
= 0,8.0,5 = 0,4mol
2
)OH(Ca
n
= 0,8.0,2 = 0,16mol
Sôc tõ tõ a mol CO2 vµo dung dÞch hh gåm KOH vµ Ca(OH)2, thø tù ph¶n øng x¶y ra nh sau:
CO2 + Ca(OH)2
→
CaCO3 + H2O (1)
0,16mol 0,16mol 0,16mol
CO2 + 2KOH
→
K2CO3 + H2O (2)
0,2mol 0,4mol 0,2mol
CO2 + K2CO3 + H2O
→
2KHCO3 (3)
0,2mol 0,2mol
CO2 + CaCO3 + H2O
→
Ca(HCO3)2 (4)
0,16mol 0,16mol
NhËn xÐt: * Theo ptr×nh 1 cã: NÕu
16,00
≤≤
a
th×
3
CaCO
n
t¨ng tõ 0 ®Õn 0,16mol
* Theo ptr×nh 2 vµ 3 cã:
56,016,0
≤≤
a
th×
molnCaCO 16,0
3
=
* Theo ptr×nh 4 cã:
72,056,0
≤≤
a
th×
3
CaCO
n
gi¶m tõ 0,16 ®Õn 0mol
a
≤
72,0
kh«ng cßn kÕt tña trong dung dÞch
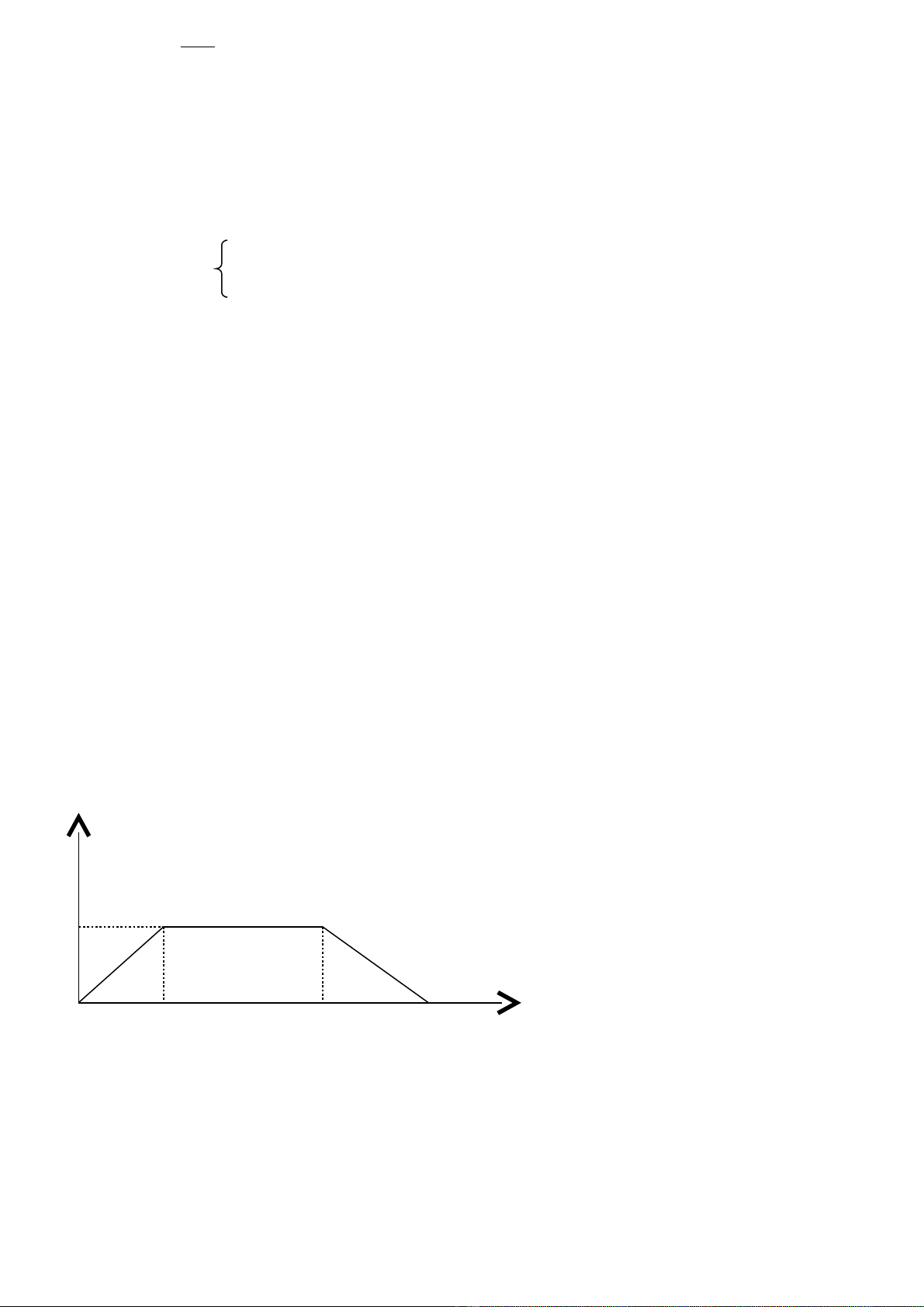
b.Theo ®å thÞ ta cã:
3
caCO
n
max = 0,16mol khi
2
CO
n
tho¶ m·n:
56,016,0
≤≤
a
c.
3
CaCO
n
= 10/100 = 0,1mol
→
23 )OH(CaCaCO nn
<
cã 2 kh¶ n¨ng:
* kh¶ n¨ng 1: Ca(OH)2 d Theo ph¬ng tr×nh 1 cã
mol1,0nn
32
CaCOCO
==
* kh¶ n¨ng 2: CO2 hoµ tan mét phÇn kÕt tña Theo pt 4 kÕt hîp ®å thÞ cã
2
CO
n
= 0,72-0,1 = 0,62mol
d. a=0,6>0,56
→
kÕt tña bÞ hoµ tan mét phÇn
32
CaCO)4(CO
nn
=
bÞ hoµ tan = 0,6 – 0,56 = 0,04mol
→
3
CaCO
n
cßn l¹i = 0,16 – 0,04 = 0,12mol
3
CaCO
m
= 0,12.100 = 12g
Câu 4: a. ë cïng ®k tØ lÖ vÒ sè mol b»ng tØ lÖ vÒ thÓ tÝch
Cho D ®i qua bét Ni, toc thu ®îc hi®rocabon duy nhÊt lµ CnH2n+2:
O
0,16
nCaCO3
nCO2
0,16 0,56 0,72

CnH2n-2 + 2H2
→
ctNi
o
,
CnH2n+2 (1)
2
H
V
= V hh gi¶m = 100 – 70 = 30cm3
theo ptr×nh 2:
22n2n HHC V.2/1V
=
−
= 30/2 = 15cm3 VËy
2n2n
HC
V
+
= 100 – 30 – 15 = 55cm3
Ph¬ng tr×nh ®èt ch¸y D:
H2 + 1/2O2
→
ct
o
H2O (2)
CnH2n+2 +(3n+1)/2O2
→
ct
o
nCO2+(n+1)H2O (3) CnH2n-2 +(3n-1)/2O2
→
ct
o
nCO2+(n-1)H2O (4) 55
55n (cm3) 15 15n
2
CO
V
= 55n + 15n = 210cm3
→
n = 210/70 = 3CTPT cña c¸c hi®rocacbon trong D lµ: C3H8; C3H4
b.
)()(
,,
EmDm
HCHC
Σ=Σ
→
VO2 cÇn dïng ®èt ch¸y 100cm3 D b»ng ®èt ch¸y 70cm3 E.
C3H8 + 5O2
→
ct
o
3CO2 + 4H2O
70 350 (cm3)
VËy
2
O
V
= 350cm3
Câu 5:
moln
H
11,0
4,22
464,2
2
==
Gäi x; y lÇn lît lµ sè mol cña M; Al trong 3,18 gam hh X (x; y>0)
Theo bµi ta cã: Mx + 27y = 3,18 (1*)
Cho X t¸c dông v¬i H2SO4 lo·ng theo ptr×nh:
2M + H2SO4
→
M2SO4 + H2 (1)
x x/2 x/2 (mol)
2Al + 3H2SO4
→
Al2(SO4)3 + 3H2 (2)
y y/2 3y/2 (mol)
2
H
n
= x/2 + 3y/2 = 0,11
→
x + 3y = 0,22 (2*)
Cho Ba(OH)2 vµo dd Y:
M2SO4 + Ba(OH)2
→
BaSO4 + 2MOH (3)
x/2 x/2 x (mol)
Al2(SO4)3 + 3Ba(OH)2
→
3BaSO4 + 2Al(OH)3 (4)
y/2 3y/2 y (mol)
MOH + Al(OH)3
→
MAlO2 + 2H2O (5)
Theo 1; 2; 3; 4 cã
24
HBaSO
nn
=
= 0,11mol
4
BaSO
m
= 0,11.233 = 25,63g<27,19
→
trong kÕt tña cã Al(OH)3:
3
)OH(Al
m
= 27,19 – 25,63 = 1,56g
3
)OH(Al
n
= 1,56/78 = 0,02mol
Theo ptr×nh 5 cã
3
)OH(Al
n
bÞ hoµ tan = nMOH = x
→
3
)OH(Al
n
kÕt tña = y-x = 0,02 (3*)
Tõ 1*; 2* vµ 3* cã hÖ: Mx + 27y = 3,18 x = 0,04
x + 3y = 0,22
→
y = 0,06
y – x = 0,02 M = 39
VËy kim lo¹i kiÒm M lµ Kali (K)
b.
42SOK
n
thªm vµo = 1,74/174 = 0,01mol
→
sau khi thªm cã:
342 )SO(Al
n
= 0,03mol
42SOK
n
= 0,02 + 0,01 = 0,03mol
OH
2
m
kÕt tinh = 28,44 – 0,03.174 – 0,03.342 = 12,96g
OH
2
n
kÕt tinh = 12,96/18 = 0,72mol
Gäi CT cña tinh thÓ muèi kÐp lµ aK2SO4.bAl2(SO4)3.cH2O
Cã a:b:c = 0,03:0,03:0,72 = 1:1:24
VËy CT cña muèi kÐp: K2SO4.Al2(SO4)3.24H2O
kú thi tuyÓn sinh líp 10 thpt chuyªn NguyÔn Tr·i - n¨m häc 2009 – 2010 M«n thi: ho¸ häc
së gi¸o dôc vµ ®µo t¹o H¶i d¬ng
C©u I (2.5®iÓm)
1. §èt quÆng pirit s¾t trong kh«ng khÝ thu ®îc khÝ SO2. DÉn tõ tõ khÝ SO2 ®Õn d vµo dung dÞch
Ca(OH)2 thu ®îc dung dÞch A. Cho tõ tõ dung dÞch NaOH vµo dung dÞch A cho ®Õn d.

Nªu hiÖn tîng x¶y ra trong dung dÞch vµ viÕt c¸c ph¬ng tr×nh ph¶n øng x¶y ra theo tr×nh tù thÝ
nghiÖm trªn.
2. X¸c ®Þnh c«ng thøc ho¸ häc cña c¸c chÊt ®îc kÝ hiÖu b»ng c¸c ch÷ c¸i trong ngoÆc ®¬n råi viÕt
c¸c ph¬ng tr×nh ph¶n øng theo c¸c s¬ ®å ph¶n øng sau:
a. (M) + HCl → (A1) + H2d. (A2) + NaOH → (E) (r) + (A3)
b. (M) + H2SO4 → (B1) + (B2) + H2O e. (B1) + NaOH → (E) (r) + (B3)
c. (A1) + Cl2 → (A2)f. (E)
0
t
(F) + H2O
C©u II (2.0 ®iÓm)
1. Tr×nh bµy ph¬ng ph¸p ho¸ häc nhËn biÕt c¸c lä riªng biÖt mÊt nh·n cã chøa: Dung dÞch glucoz¬; dung
dÞch saccaroz¬; dung dÞch axit axetic; níc. ViÕt c¸c ph¬ng tr×nh ph¶n øng x¶y ra (nÕu cã).
2. Tr×nh bµy ph¬ng ph¸p tinh chÕ CH4 tinh khiÕt tõ hçn hîp khÝ gåm: CH4, C2H2, CO2, C2H4. ViÕt c¸c ph-
¬ng tr×nh ph¶n øng x¶y ra (nÕu cã).
C©u III (2.5®iÓm)
Cho m gam Na vµo 500 ml dung dÞch HCl a M. Khi ph¶n øng x¶y ra hoµn toµn thu ®îc 13,44 lÝt H2
(®ktc) vµ dung dÞch A. Cho dung dÞch A vµo 500 ml dung dÞch AlCl3 0,5M, ph¶n øng xong thu ®îc 7,8
gam kÕt tña vµ dung dÞch B.
1. TÝnh m vµ a.
2. Cho 4,48 lÝt CO2 (®ktc) tõ tõ vµo dung dÞch B. TÝnh khèi lîng kÕt tña thu ®îc (nÕu cã).
C©u IV(2.0 ®iÓm)
1. Hçn hîp X gåm 0,7 mol C2H5OH vµ 0,8 mol mét axit h÷u c¬ A (RCOOH). Cho dung dÞch H2SO4
®Æc vµo X, ®un nãng mét thêi gian thu ®îc hçn hîp Y. §Ó trung hoµ võa hÕt axit d trong Y cÇn 200 ml
dung dÞch NaOH 2M. C« c¹n hçn hîp sau ph¶n øng trung hoµ thu ®îc 38,4 gam muèi khan.
TÝnh hiÖu suÊt ph¶n øng este ho¸ vµ x¸c ®Þnh c«ng thøc cña A.
2. Mét lo¹i g¹o chøa 80% tinh bét ®îc dïng ®Ó ®iÒu chÕ rîu etylic theo s¬ ®å sau:
Tinh bét
(1)
Glucoz¬
(2)
Rîu etylic
Víi hiÖu suÊt cña giai ®o¹n 1 vµ 2 lÇn lît lµ 80% vµ 60%. §Ó ®iÒu chÕ 5 lÝt rîu etylic 400 cÇn bao
nhiªu kilogam g¹o trªn? BiÕt D
2 5
C H OH
= 0,8 gam/ml.
C©u V ( 1.0 ®iÓm)
Hçn hîp khÝ X gåm hi®rocacbon CnH2n-2 (ph©n tö cã mét liªn kÕt 3) vµ H2. d
2
/X H
=6,5. §un nãng X (cã
Ni xóc t¸c) ®Ó ph¶n øng x¶y ra hoµn toµn ®îc hçn hîp Y. Cho Y qua dung dÞch brom thÊy dung dÞch
brom bÞ nh¹t mµu. X¸c ®Þnh c«ng thøc ph©n tö cña CnH2n-2 vµ phÇn tr¨m thÓ tÝch mçi chÊt trong X.
§¸p ¸n
Câu 1: 1. HiÖn tîng:
- DÉn SO2 vµo dd Ca(OH)2 lóc ®Çu xuÊt hiÖn kÕt tña vÈn ®ôc, sau ®ã kÕt tña tan trë l¹i t¹o thµnh dd
trong suèt.
- Nhá dd NaOH vµo dd trong suèt l¹i thu ®îc kÕt tña tr¾ng.
PTHH: 2FeS2 + 11/2O2
0
t
2Fe2O3 + 4SO2
SO2 + Ca(OH)2 → CaSO3 + H2O SO2 + CaSO3 + H2O → Ca(HSO3)2
SO2 + H2O → H2SO3 ; H2SO3 + NaOH → NaHSO3 + H2O
Ca(HSO3)2+ NaOH → CaSO3 + NaHSO3 + H2O; NaHSO3 + NaOH → Na2SO3 +H2O
2. * M: Fe; A1: FeCl2; B1: Fe2(SO4)3; B2: SO2; A2: FeCl3; E: Fe(OH)3; A3: NaCl; B3: Na2SO4; Fe2O3
Fe + 2HCl → FeCl2 + H2; 2Fe + 6H2SO4®
0
t
Fe2(SO4)3 + 3SO2 + 6H2O
FeCl2 + 1/2Cl2 → FeCl3; FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4;2Fe(OH)3
0
t
Fe2O3 + 3H2O
Câu 2: 1. - LÊy mçi ho¸ chÊt mét lîng nhá ra c¸c èng nghiÖm t¬ng øng, ®¸nh dÊu c¸c mÉu TN.
Nhóng quú tÝm vµo c¸c mÉu, quú tÝm ho¸ ®á lµ dd CH3COOH, c¸c mÉu cßn l¹i kh«ng lµm quú tÝm ®æi
mµu
- Cho vµo c¸c mÉu cßn l¹i dung dÞch AgNO3/NH3, ®un nãng. MÉu nµo cã ph¶n øng tr¸ng g¬ng lµ
glucoz¬.
-- Cho c¸c mÉu cßn l¹i vµi giät dd H2SO4 lo·ng, ®un nãng sau ®ã trung hoµ b»ng dd NaOH råi cho t¸c
dông víi dung dÞch AgNO3/NH3, ®un nãng. MÉu cã p tr¸ng g¬ng suy ra mÉu ban ®Çu lµ dd saccaroz¬,
mÉu cßn l¹i lµ níc.
* C¸c PTHH:
C12H22O11 +H2O
0
2 4;
H SO t
C6H12O6 + C6H12O6 C6H12O6 + Ag2O
0
3;
NH t
C6H12O7 + 2Ag
2.- DÉn toµn bé hçn hîp qua c¸c b×nh m¾c nèi tiÕp.

- B×nh 1 chøa dd Ca(OH)2 d, toµn bé khÝ CO2 sÏ bÞ hÊp thô.CO2 + Ca(OH)2 → CaCO3 + H2O
KhÝ qua b×nh 1 ®Õn b×nh 2 chøa dung dÞch brom d, toµn bé C2H2, C2H4 bÞ hÊp thô.
C2H4 + Br2 → C2H4Br2 ; C2H2 + 2Br2 → C2H4Br4
- KhÝ CH4 vµ h¬i níc tho¸t khái b×nh 2 qua b×nh 3 chøa dd H2SO4 ®Æc d thu ®îc CH4 tinh khiÕt.
Câu 3: 1: C¸c PTHH
2Na + 2HCl → 2NaCl + H2(1) 2Na + 2H2O →2NaOH + H2(2)
3NaOH + AlCl3 → Al(OH)3 + 3NaCl(3) 4NaOH + AlCl3→ NaAlO2 + 2H2O + 3NaCl(4)
n
2
H
= 0,6 (mol); n
3
AlCl
= 0,5.0,5 = 0,25 (mol); n
3
( )Al OH
= 7,8:78 = 0,1 (mol)
- V× A t¸c dông ®îc víi dd AlCl3 t¹o kÕt tña nªn cã p (2)
-Theo pt (1), (2) nNa = nNaOH + nNaCl = 2n
2
H
= 0,6.2 = 1,2 (mol) VËy m = 1,2.23 = 27,6 g
- V× n
3
( )Al OH
= 0,1 < n
3
AlCl
= 0,25 nªn cã 2 trêng hîp
* TH1: Kh«ng x¶y ra p (4) th× sau p (3) AlCl3 d.
- Theo pt (3) ta cã: nNaOH = 3n
3
( )Al OH
= 0,1.3 = 0,3 (mol)
Theo pt (1) → nHCl = nNaCl = (1,2 - 0,3) = 0,9 (mol) VËy a = 0,9:0,5 = 1,8(M)
* TH 2: X¶y ra c¶ p (4) Theo pt (3): n
3
( )Al OH
= n
3
AlCl
= 0,1 (mol)
Nªn sè mol AlCl3 ë p (4) lµ: 0,25 - 0,1 = 0,15 (mol).
Theo pt (3),(4) ta cã: nNaOH = 3.0,1 + 4.0,15 = 0,9 (mol)
Theo pt (1) → nHCl = nNaCl = (1,2 - 0,9) = 0,3 (mol)VËy a = 0,3:0,5 = 0,6(M)
2. nCO2 = 0,2 (mol)
TH 1: Dd B chøa AlCl3 d vµ NaCl sÏ kh«ng t¸c dông ®îc víi CO2 nªn mkÕt tña = 0(gam).
TH 2: dd B chøa NaAlO2, NaCl. Khi cho B p víi CO2 chØ cã p: NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
(5)
Theo pt (5) n
3
( )Al OH
= n
2
NaAlO
= 0,15 (mol) → n
2
CO
d = 0,2 - 0,15 = 0,05 (mol)
VËy khèi lîng kÕt tña thu ®îc lµ: m
3
( )Al OH
= 0,15.78 = 11,7 (gam)
Câu 4: 1: RCOOH + C2H5OH
0
2 4
;H SO t
RCOOC2H5 + H2O(1)
RCOOH + NaOH → RCOONa + H2O (2)
Ta cã n RCOOH = 0,8> n
2 5
C H OH
= 0,7 , kÕt hîp víi pt (1) nªn axit d, hiÖu suÊt p tÝnh theo rîu.
nNaOH = 0,2.2 = 0,4 (mol)
Theo (2) n RCOOH = n RCOONa = 0,4 (mol)
Theo (1)→ n
2 5
C H OH
p = nRCOOH p = 0,8 - 0,4 = 0,4 (mol) VËy H =
0,4.100 57,14%
0,7 ;
- Khi c« c¹n hçn hîp sau ph¶n øng trung hoµ th× níc, rîu, axit, este ®Òu bÞ bay h¬i hoµn toµn. 38,4 gam muèi khan
chÝnh lµ RCOONa.
M RCOONa. = 38,4: 0,4 = 96 → MR = 29 (C2H5-)VËy c«ng thøc cña A lµ : C2H5COOH.
2. (-C6H10O5-)n + nH2O
0
2 4;
H SO t
nC6H12O6(1)C6H12O6
0
;men t
2C2H5OH + 2CO2(2)
Vrîu =
40.5 2( )
100 l=
→mrîu = 2.1000.0,8 = 1600 (gam) = 1,6(kg)
HiÖu suÊt chung cña c¶ 2 giai ®o¹n lµ: H = 0,8.0,6 = 48%
Theo pt (1)(2) víi H = 48% th× khèi lîng tinh bét cÇn dïng lµ ®Ó ®iÒu chÕ 1,6 kg rîu lµ: m
6 10 5
( )n
C H O− −
=
1,6.162.100 5,870( )
92.48 kg
VËy khèi lîng g¹o cÇn dïng lµ: mg¹o ≈
5,870.100 7,337( )
80 kg=
Câu 5: 1.Gäi sè mol cña CnH2n-2 lµ x mol; sè mol H2 lµ y (mol).
C¸c ph¶n øng cã thÓ cã:
CnH2n-2 + H2
0
,Ni t
CnH2n CnH2n-2 + 2H2
0
,Ni t
CnH2n+2
V× Y lµm nh¹t mµu dd brom mµ ph¶n øng hoµn toµn chøng tá H2 ®· p hÕt → y < 2x






















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



