
§Þnh tÝnh cation nhãm I: Ag+, Pb2+, Hg22+
Môc tiªu
1. T×m ®−îc tõng cation nhãm I dùa vµo c¸c ph¶n øng ®Æc tr−ng cña chóng.
2. Gi¶i thÝch c¸c hiÖn t−îng x¶y ra vµ viÕt c¸c ph−¬ng tr×nh ph¶n øng trong qu¸
tr×nh tiÕn hµnh thùc nghiÖm.
1. Dông cô - hãa chÊt - Thuèc thö
Dông cô
- §Ìn cån
- §òa thñy tinh
- KÑp gç
- èng nghiÖm c¸c lo¹i
- èng nghiÖm ly t©m
- M¸y ly t©m
Ho¸ chÊt, thuèc thö
- Dung dÞch ph©n tÝch chøa c¸c cation:
Ag+, Pb2+, Hg22+
- HCl 6 N, HCl 2 N
- HNO3 6 N
- NH4OH ®Æc
- KI 0,1 M
- K2CrO4 5%
2. Thùc hµnh
2.1. LÊy 1mL dung dÞch ph©n tÝch vµo èng nghiÖm s¹ch, thªm vµo ®ã tõng
giät dung dÞch HCl 6N ®Õn m«i tr−êng acid m¹nh ®Ó kÕt tña hoµn toµn
nhãm I (nhËn biÕt qu¸ tr×nh kÕt tña ®· xong khi giät HCl thªm vµo thµnh
èng nghiÖm th× ë chç tiÕp xóc gi÷a giät HCl vµ dung dÞch ph©n tÝch kh«ng
thÊy xuÊt hiÖn kÕt tña thªm n÷a). §un nãng nhÑ ®Ó kÕt tña vãn côc dÔ
t¸ch. §Ó nguéi, ly t©m, t¸ch phÇn kÕt tña nhãm I (gäi lµ T1) chøa: AgCl,
PbCl2, Hg2Cl2 vµ phÇn n−íc ly t©m (L1) chøa c¸c cation nhãm kh¸c.
2.2. Röa g¹n 3 lÇn kÕt tña T1 b»ng n−íc cÊt cã pha thªm vµi giät HCl lo·ng
2N (thªm n−íc röa vµo T1, l¾c kü, ly t©m, g¹n lÊy kÕt tña). Thªm vµo kÕt tña
®· röa ë trªn 1 mL n−íc cÊt, ®un ®Õn s«i, lóc nµy PbCl2 sÏ tan ra. Ly t©m g¹n
lÊy kÕt tña T2 (chøa: AgCl vµ Hg2Cl2) vµ n−íc ly t©m L2 (chøa PbCl2).
108
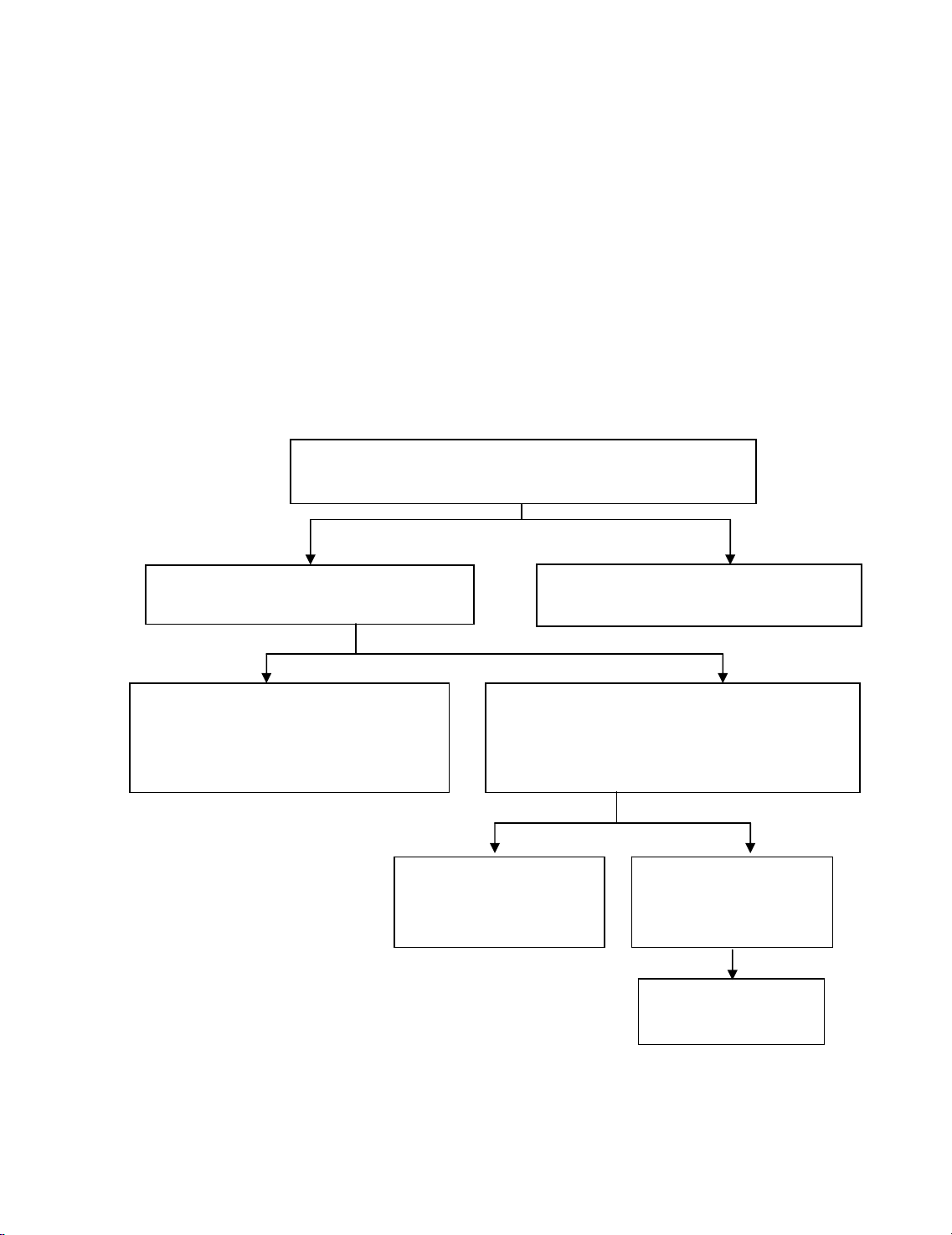
2.3. Thªm vµo n−íc ly t©m L2 vµi giät thuèc thö KI 0,1M, nÕu thÊy xuÊt
hiÖn kÕt tña PbI2 mµu vµng ®Ëm, chøng tá cã chøa Pb2+. §un nãng, kÕt tña
l¹i tan ra, lµm l¹nh d−íi vßi n−íc ch¶y, hoÆc ®Ó nguéi dÇn sÏ thu ®−îc tinh
thÓ mµu vµng lãng l¸nh r¬i xuèng (ph¶n øng m−a vµng).
HoÆc cã thÓ nhËn biÕt Pb2+ b»ng c¸ch cho n−íc ly t©m L2 t¸c dông víi
vµi giät K2CrO4 5% thÊy xuÊt hiÖn kÕt tña mµu vµng PbCrO4.
2.4. Thªm vµo kÕt tña T2 NH4OH ®Æc, l¾c kü, nÕu thÊy xuÊt hiÖn mµu tña
x¸m ®en (do t¹o thµnh Hg + NH2HgCl), chøng tá cã ion Hg22+. Ly t©m, lÊy
n−íc ly t©m, acid hãa b»ng HNO3 6N, nÕu thÊy xuÊt hiÖn kÕt tña tr¾ng trë
l¹i (AgCl) chøng tá cã ion Ag+.
S¬ ®å 1. S¬ ®å thùc hµnh ph©n tÝch Cation nhãm I: Ag+, Hg22+, Pb2+
Tña T1 (AgCl, Hg2Cl2, PbCl2) röa b»ng
H2O + HCl 2N. §un s«i, ly t©m nãng
N−íc ly t©m L1
(cã cation c¸c nhãm II, III, IV, V)
N−íc ly t©m L2: Pb2+
+ KI 0,1M → PbI2 ↓ vµng
+ K2CrO4 5% → PbCrO4 ↓ vµng
t cã Pb2+
AgCl ↓ tr¾ng
t cã Ag+
N−íc ly t©m:
Ag(NH3)2]+
+ HNO3 6N
KÕt tña ®en x¸m cña
Hgo + NH2HgCl
t cã Hg22+
Tña T2 (AgCl, Hg2Cl2) + NH4OH ®Æc, l¾c kü
Dung dÞch ph©n tÝch + HCl 6N (tõng giät)
L¾c kü, ly t©m, lÊy kÕt tña
109


























