3
M$ Đ%U
1. Lý do chn ñ' tài
Liên kt hiñro kiu A-H···B là mt loi tương tác không cng hóa tr có
tm quan trng rt ln không ch trong lĩnh vc hóa hc mà c sinh hc,
hóa sinh và vt lý. Đc bit, liên kt hiñro dng C-H···O có mt trong cu
trúc protein, ADN, ARN. Vì vy có th nói rng “liên kt hiñro gn li n vi
s sng và các quá trình chuyn hóa”.
Liên kt hiñro c! ñin hay liên kt hiñro chuyn di ñ" ñã ñưc
Pauling ñưa ra. Nhìn chung, bn cht c#a liên kt hiñro chuyn di ñ" là do
tương tác tĩnh ñin gi$a H mang mt phn ñin tích dương và nguyên t% B
có ñ âm ñin ln mang mt phn ñin tích âm. Thuc tính tiêu biu c#a
loi liên kt này là: khi liên kt hiñro hình thành, ñ dài liên kt A-H tăng
(kém b n hơn), tn s dao ñng hóa tr liên kt A-H gim - dch chuyn v
vùng sóng ñ" và cưng ñ hng ngoi tương &ng tăng so vi monome ban
ñu. Tuy nhiên, năm 1980, Sandorfy và cng s bng thc nghim ñã phát
hin trong dung dch mt loi liên kt hiñro mi có như: ñ dài liên kt A-H
b rút ngn, tn s dao ñng hóa tr tăng - dch chuyn v vùng sóng xanh
và cưng ñ hng ngoi c#a liên kt A-H trong ph&c hình thành thưng
gim so vi monome ban ñu. Vì vy, loi liên kt này ñưc gi là liên kt
hiñro chuyn di xanh.
CO
2
là tác nhân chính gây ra hiu &ng nhà kính và hàm lưng CO
2
trong khí quyn ngày càng tăng do quá trình công nghip hóa. Tuy nhiên,
CO
2
có nhi u &ng d'ng quan trng trong hóa hc và công nghip, ñc bit
là CO
2
l"ng siêu ti hn (nhit ñ trên 31
o
C, áp sut 73,8 bar). Hin ti công
ngh siêu ti hn vi vic dùng dung môi CO
2
ñ tách, chit các sn
ph(m,..ñang rt phát trin và ñưc s% d'ng ) nhi u quc gia trên th gii,
trong ñó có Vit Nam (Vin Hóa hc Công nghip ñã nhp công ngh này
vào năm 2010). Vic s% d'ng dung môi scCO
2
thay th các dung môi h$u
4
cơ ñc hi nh vào tính không ñc, r*, có sn trong t nhiên và các ñi u
kin v dung môi “m m d*o”. Trong thi gian gn ñây dung môi l"ng
scCO
2
còn ñưc s% d'ng trong t!ng hp hóa hc,vt liu polyme và công
ngh x him. Như vy, vi dung môi CO
2
ñang m) ra mt hưng mi cho
ngành công nghip xanh c#a th gii. Tuy nhiên, ñ s% d'ng hiu qu
scCO
2
và ñnh hưng tìm kim vt liu “ưa CO
2
” thân thin môi trưng ñòi
h"i tt yu phi hiu bn cht và ñ b n các tương tác gi$a CO
2
vi các hp
phn tương tác.
Mt s nghiên c&u lý thuyt và thc nghim ñ hiu bn cht tương tác
ñã ñưc thc hin, ñó là tương tác c#a CO
2
vi CO
2
và mt s hp cht h$u
cơ như CH
4
, C
2
H
6
,CH
3
CHO, CHF
2
,…Tuy nhiên bn cht c#a các tương tác
v+n chưa ñưc gii thích th"a ñáng, liu có tn ti liên kt hiñro kiu C-
H···O ñóng vai trò b! tr cùng vi tương tác axit-bazơ Lewis trong vic làm
b n ph&c hay không. Hin nay theo hiu bit c#a chúng tôi, chưa có công
b nghiên c&u v anken và d+n xut c#a nó tương tác vi CO
2
,
trong khi
anken ñc bit etylen là nguyên liu quan trng ñ t!ng hp cao su, cht
d*o như PS, PE,…Do vy vic nghiên c&u ñánh giá kh năng tương tác c#a
etylen và các d+n xut th ñihalogen c#a nó vi CO
2
là cn thit. Hơn n$a
ñ phân cc c#a liên kt cng hóa tr C-H nh hư)ng như th nào ñn m&c
ñ chuyn di xanh tn s dao ñng hóa tr c#a liên kt C-H khi tham gia
liên kt hiñro C-H···O trong các ph&c cũng cn ñưc nghiên c&u.
Xut phát t- nh$ng yêu cu và tính cp thit nêu trên, chúng tôi chn ñ tài
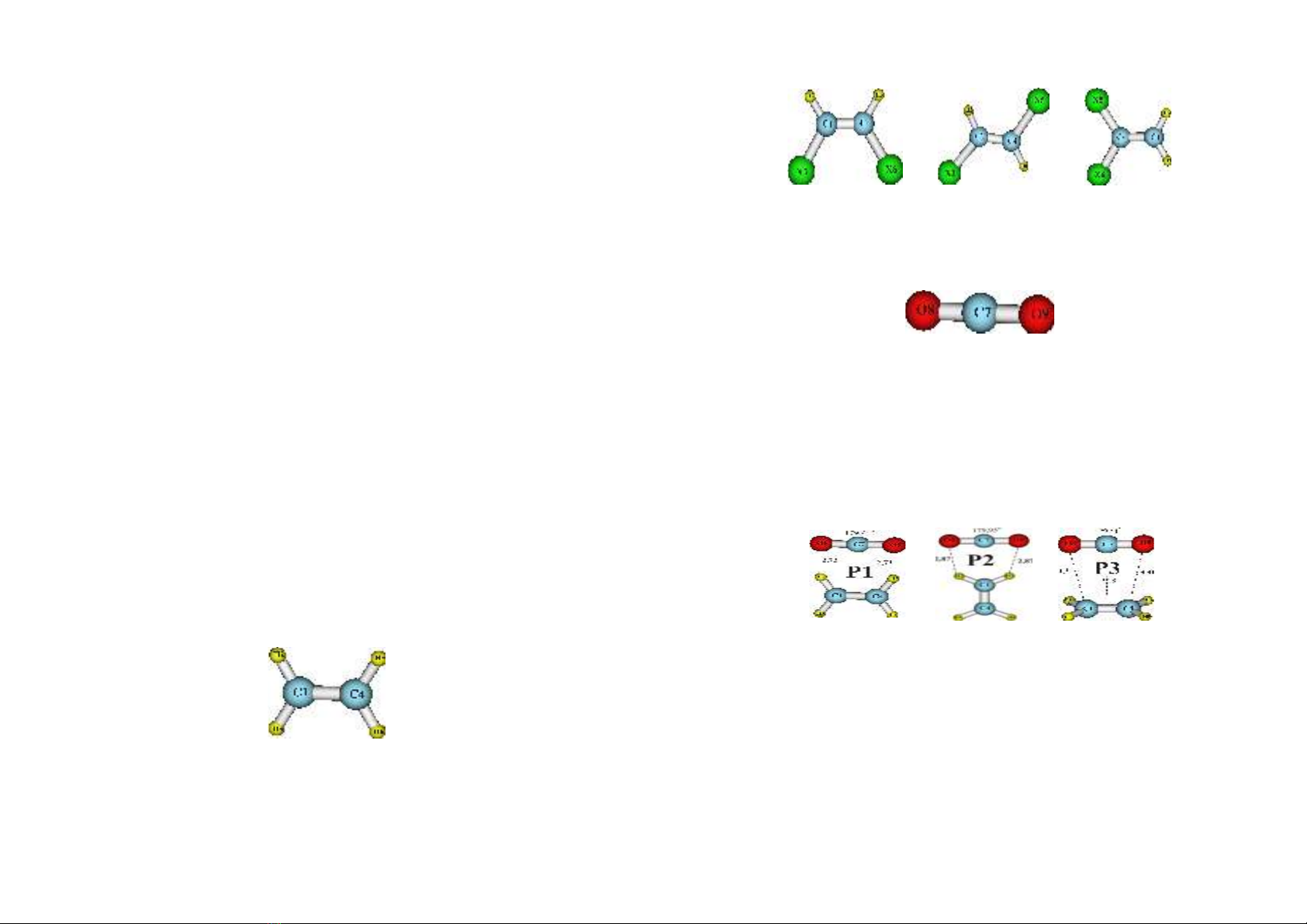
nghiên c&u: “Nghiên c(u ñánh giá kh năng tương tác c*a etylen và dn
xu+t ñihalogen vi cacbonñioxit b,ng phương pháp hóa hc lư-ng t.”.
2. M/c tiêu nghiên c(u
- Đánh giá ñ b n c#a các tương tác gi$a etylen và d+n xut th
ñihalogen (C
2
H
2
X
2
, X = F, Cl, Br) vi cacbonñioxit ) m&c ñ phân t%.