
ĐẠI HỌC QUỐC GIA TP H CH MINH
TRƯNG ĐẠI HỌC BCH KHOA
Khoa Kĩ thuật Hóa học
Chủ đề: Hệ thống sản xuất aspirin từ thiết bị vỏ áo hoạt động liên tục
cho ra 10kg sản phẩm mỗi giờ.
GVHD: TS. Lê Phan Hoàng Chiêu

MỤC MỤC
MỞ ĐẦU.................................................................................................................1
CHƯƠNG 1: TỔNG QUAN..................................................................................2
1.1. Tổng quan về aspirin...................................................................................2
1.1.1. Công thức hóa học..........................................................................................2
1.1.2. Tính chất vật lý...............................................................................................2
1.1.3. Độ ổn định......................................................................................................3
1.1.4. Quy trình trong phòng thí nghiệm..................................................................4
1.2. Tổng quan về thiết bị phản ứng chính........................................................2
1.2.1. Khái niệm.......................................................................................................2
1.2.2. Nguyên lý vận hành........................................................................................2
1.2.3. Phân loại thiết bị.............................................................................................2
1.2.4. Ứng dụng........................................................................................................2
CHƯƠNG 2: QUY TRÌNH CÔNG NGHỆ.........................................................8
2.1. Quy trình công nghệ........................................................................................8
2.1.1. Thuyết minh....................................................................................................8
2.1.2. PFD minh họa.................................................................................................8
2.1.3. Các hệ ứng dụng đi kèm.................................................................................8
CHƯƠNG 3: QUY TRÌNH TNH TON............................................................8
TÀI LIỆU THAM KHẢO
PHỤ LỤC

MỞ ĐẦU
Aspirin thuộc nhóm thuốc chống viêm không steroid, có tác dụng giảm
đau, hạ sốt, chống viêm. Ngoài ra còn được dùng để chống kết tập tiểu cầu (giảm
đông máu, chống tắc mạch).
Aspirin hiện là loại thuốc được sử dụng phổ biến nhất trên thế giới. Vai trò
của nó trong việc ngăn ngừa bệnh tim mạch và mạch máu não đã mang tính cách
mạng và là một trong những thành công trong dược phẩm lớn nhất của thế kỷ
trước. Cho đến ngày nay, aspirin vẫn không ngừng được nghiên cứu về tác dụng,
như ngăn ngừa tiền sản giật, điều trị ung thư đại trực tràng,…
Với sự phát triển hiện nay, việc công nghiệp hóa nhân rộng các loại thuốc
có lợi cho sức khỏe là vô cùng cần thiết, aspirin cũng không ngoại lệ. Báo cáo
này, ta sẽ ứng dụng hệ thống thiết bị vỏ áo vào việc điều chế ra thuốc aspirin.
CHƯƠNG 1: TỔNG QUAN
1.1. Tổng quan về aspirin
1.1.1. Công thức hóa học
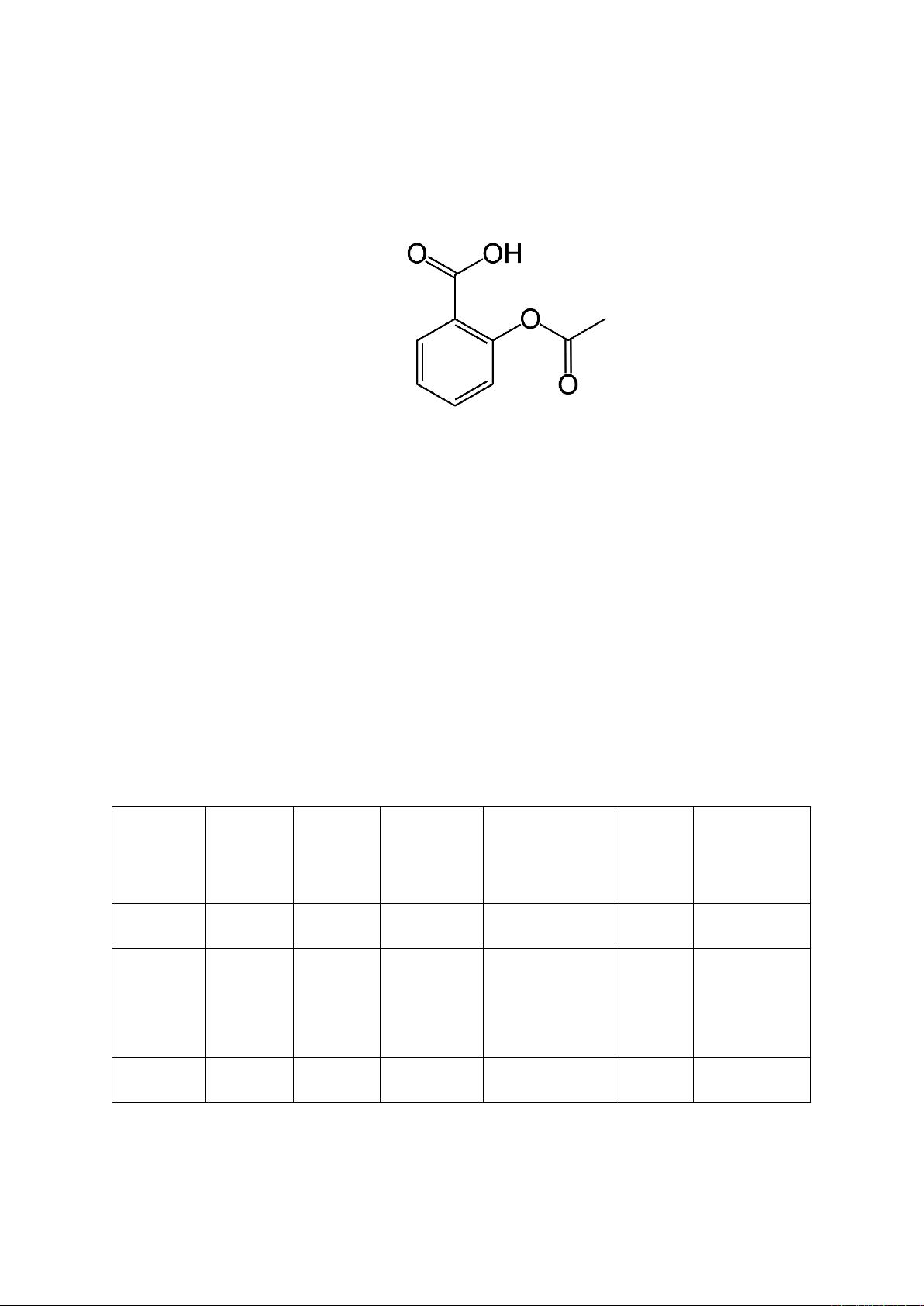
Hình 1.1. Cấu trúc hóa học của aspirin
Tên quốc tế: Acetylsalicylic acid
Mã ATC: A01A D05, B01A C06, N02B A01.
Danh pháp: Acid-2-acethoxy benzoic
Công thức phân tử: C9H804
Khối lượng phân tử: 180,2g/mol
1.1.2. Tính chất vật lý
Màu trắng hoặc gần như trắng, bột kết tinh hoặc tinh thể (thường hình
ống hoặc hình kim), không mùi hoặc có mùi nhạt.
Tên chất Nhiệt độ
nóng
chảy
Áp suất
hơi (20
-25 °C)
Thể tích
riêng
(m3/kg)
Nhiệt lượng
riêng (lỏng)
Nhiệt
lượng
riêng
(khí)
Nhiệt hóa
hơi (kJ/mol)
Aspirin 134 –
136 °C
~3.04 Pa 7.40 × 10 ⁴⁻106.4
Acid
salicylic
158.6 °C ~0.02 Pa 6.93 × 10 ⁴⁻~2.5 kJ/kg·K 79.4
(vaporization
at 460 K) /
~95
(sublimation)
Axetic
anhydride
–73 °C 533–
680 Pa
9.24 × 10 ⁴⁻~1,648 J/kg·K ~28,3
Độ tan: Aspirin khó tan trong nước (1g trong 300ml nước), dễ tan
trong ethanol (1g trong 5ml ethanol), 1g trong 17ml cloroform, và 1g trong
10ml

đến 15ml ether; ít tan trong ether tuyệt đối.
Độ tan của aspirin trong nước thay đổi theo nhiệt độ (bảng 1)
Bảng 1.1. Ảnh hưởng của nhiệt độ đến độ tan của aspirin trong nước
Nhiệt độ (t0C) Độ tan (g/ml)
25 1 trong 300
37 1 trong 100
100 1 trong 33
1.1.3. Độ ổn định
Aspirin ổn định trong không khí khô.
Trong không khí ẩm, thuốc thủy phân dần dần thành acid salicylic và
acid acetic.
pKa của aspirin là 3,6 nên nó sẽ tồn tại chủ yếu ở dạng anion ở pH>5.
Sản phẩm của sự thuỷ phân là acid salicylic và acid acetic. Có thể nhận biết
được sự thủy phân này thông qua mùi đặc trưng của acid acetic, đôi khi có
thể nhìn thấy các tinh thể acid salicylic hình kim trên bề mặt dạng thuốc rắn
(do sự thăng hoa của acid salicylic).
Tốc độ thuỷ phân aspirin xảy ra nhanh hơn nếu trong quá trình bào
chế và bảo quản ở nhiệt độ cao hơn nhiệt độ bình thường.
Ngoài ra, phản ứng thuỷ phân aspirin còn chịu ảnh hưởng của pH môi
trường. Nghiên cứu ảnh hưởng của pH đến sự thuỷ phân aspirin ở nhiệt độ
25
°c cho thấy: tốc độ thuỷ phân aspirin tăng lên trong môi trường pH < 2 hoặc
pH > 9, aspirin bền vững nhất ở pH = 2,5. Quá trình thủy phân không thay
đổi trong khoảng pH 5 - 9, tại pH = 7, hằng số tốc độ thuỷ phân là 3,7.10-6 s-
1.
1.1.4. Quy trình thực hiện thông thường trong phòng thí nghiệm:
Bước 1: Cân khoảng 1 gam axit salicylic trên một tờ giấy cân. Để làm điều
này, trước tiên hãy cân một tờ giấy cân. Đặt một ít axit salicylic lên tờ giấy
cân và cân lại. Thêm hoặc bớt chất rắn cho đến khi bạn có khoảng 1 gam
axit salicylic trên tờ giấy. Ghi lại khối lượng của tờ giấy cân cộng với chất


![Báo cáo thí nghiệm Hóa Phân tích [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2022/20220715/bakerboys08/135x160/9141657863113.jpg)











![Ô nhiễm môi trường không khí: Bài tiểu luận [Nổi bật/Chi tiết/Phân tích]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251011/kimphuong1001/135x160/76241760173495.jpg)







![Ứng dụng kỹ thuật trao đổi ion trong điện phân: Bài tiểu luận [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250829/sonphamxuan1808/135x160/97341756442892.jpg)



