ỹ
Cô :Thu v Tel: 0932.546.381
2014
ọ
: ………………
H và tên
NHÓM HALOGEN
Ứ
Ữ
Ầ
Ắ
Ế
A.
Ả KI N TH C CĂN B N C N N M V NG:
ồ g m các nguyên t
Nhóm halogen (nhóm VIIA, 7e l p ngoài cùng)
5,35
ố
ạ
Flo ( 19
phóng x )
9 F), clo (
35 Br), iot ( 127
ố : 53 I), Atatin( 210
85 At, nguyên t
ử
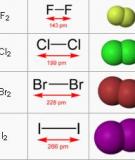
17 Cl), brom ( 80 Tính phi kim, tính oxi hóa: F2 > Cl2 > Br2 > I2 < Cl < Br < I Tính kh : F Tính axit : HF < HCl < HBr < HI
ế
ạ
axit y u axit m nh
↓
AgF AgCl , AgBr , AgI
↓ ạ
ắ
↓ Không tr ng vàng nh t vàng
ỉ
ấ
ệ
ộ
ỉ
Flo ch có s oxi hóa 1 trong m i h p ch t nên flo ch có tính oxi hóa, flo có đ âm đi n và tính oxi
ấ
ớ
↓ ọ ợ ố . 1, +1, +3, +5, +7
ố ấ ả hóa l n nh t trong t t c các nguyên t ủ ố S oxi hóa c a clo, brom , iot:
B.
ớ
Ệ
ủ ử ớ Câu 1: C u hình electron l p ngoài cùng c a nguyên t các nguyên t halogen: ố C. ns2np5 D. ns2
B. ns2np3 ấ ể
ơ ấ ườ ệ ừ ừ ử ng là ch t khí đi u ki n th ủ Câu 2: Đ c đi m chung c a các đ n ch t halogen: A. B. v a có tính oxi hóa, v a có tính kh
ụ ạ D. tác d ng m nh v i n ớ ướ c
ủ ể ố ướ halogen nào d i đây là không đúng:
ử ả ợ ạ ự ớ ấ ị
BÀI T PẬ Ắ Ầ PH N TR C NGHI M ấ A. ns2np4 ặ ở ề C. có tính oxi hóa m nhạ ặ Câu 3: Đ c đi m chung c a các nguyên t A.
có kh năng thu thêm 1 electron ử ủ ọ ợ ố nguyên t ớ C. l p electron ngoài cùng c a nguyên t có 7 electron ế ộ B. t o ra h p ch t liên k t c ng hóa tr có c c v i hiđro ấ D. có s oxi hóa 1 trong m i h p ch t
:ố
ệ ớ ộ ồ ạ ấ ướ ạ ề ấ ợ B. t n t ỏ i trong v trái đ t d i d ng h p ch t nhi u Câu 4: Trong các halogen, clo là nguyên t ấ Có đ âm đi n l n nh t A. nh tấ
ố ạ ấ C. Có s oxi hóa 1 trong m i h p ch t
ọ ợ ừ ướ ử ừ ấ ấ D. có tính phi kim m nh nh t ấ i đây, clo v a đóng vai trò là ch t kh , v a đóng vai trò là ch t oxi hóa:
2
→ → CuCl Cu + Cl2 ả ứ Câu 5: Ph n ng nào d A.
A. NaCl
C. Cl2 + H2O ⇄ HCl + HClO ệ ượ ế ằ ề B. Fe + Cl2 FeCl 3 D. H2 + Cl2 2HCl ợ Câu 6: trong phòng thí nghi m, khí clo th ng đ c đi u ch b ng cách oxi hóa h p ch t nào sau đây: ấ D. HCl C. KMnO4 ườ B. KCl ượ ệ ườ ề Câu 7: trong công nghi p, khí clo th ng đ ệ ả ị ị ụ ớ ị B. Đi n phân NaCl nóng ch y D. dùng F2 tác d ng v i dung d ch NaCl
2 v i Hớ
ệ ệ ả ứ ở ề ủ ế ằ c đi u ch b ng cách: A. đi n phân dung d ch NaCl bão hòa, có màng ngăn C. đi n phân dung d ch NaCl bão hòa, không có màng ngăn ả 2 x y ra đi u ki n nào sau đây?
ố ệ oC i, 25 C. Trong bóng t iố D. Nhi ệ ộ ướ oC i 0
2 m là
ấ B. Trong bóng t A. Cl2 B. Br2 t đ d D. I2 C. F2
ặ ặ ị ấ A. dung d ch Hị C. CaO D. dung d ch NaOH đ c ẩ B. Na2SO3 khan
Câu 8: ph n ng c a khí Cl A. ế Có chi u sáng ỉ Câu 9: Ch t ch có tính oxi hóa: ể Câu 10:(CĐ09) Ch t dùng đ làm khô khí Cl ậ 2SO4 đ m đ c ể ấ
ậ B. NaOH r nắ P2O5 ặ C. H2SO4 đ m đ c D. CaCl2 khan Câu 11: Ch t không dùng đ làm khô khí hiđro clorua: A.
Ớ
L P 10 CB
ỹ
Cô :Thu v Tel: 0932.546.381
2014
to
ả ứ ể ề ư ế ệ ệ ệ
> 400oC ậ
B. Cl2 + H2O ⇄ HCl + HClO Câu 12: ph n ng dùng đ đi u ch khí hiđro clorua trong phòng thí nghi m cũng nh công nghi p hi n nay: A.
ặ Na→ 2SO4 + HCl
H2 + Cl2 2HCl C. Cl2 + SO2 + 2H2O 2HCl + H2SO4 D. NaCl tinh thể + H2SO4 đ m đ c
ậ
ặ NaHSO
4 + HX(khí)
→ ả ứ NaX(r n) ắ + H2SO4 (đ m đ c)
ể ề ả ứ ế Câu 13: (ĐHA14) Cho ph n ng: Các hiđro halogenua (HX) có th đi u ch theo ph n ng trên là:
ướ
B. HCl, HClO, H2O C. NaCl, NaClO3, H2O
D. NaCl, NaClO4, H2O
ẩ
ấ
ướ
ạ
ử
Cl trong NaClO có s oxi hóa +1 th hi n tính oxi hóa m nh
Câu 16: N c Giaven có tính ch t sát trùng và t y màu là do: ể ệ ạ
có tính oxi hóa m nh
ố A. nguyên t ử ủ B. NaClO phân h y ra oxi nguyên t 2 có tính oxi hóa m nhạ ủ C. NaClO phân h y ra Cl ướ D. NaCl trong n
A. HCl, HBr và HI B. HF và HCl C. HBr và HI D. HF, HCl, HBr và HI Câu 14:(ĐHB09) Cho các ph n ng sau: NH4Cl + CO2 + H2O. (d) 2HCl + Zn (cid:0) (a) 4HCl + PbO2 (cid:0) (c) 2HCl + 2HNO3 (cid:0) ả ứ ố (b) HCl + NH4HCO3 (cid:0) ZnCl2 + H2. C. 1 B. 3. D. 4. ử ấ S ph n ng trong đó HCl th hi n tính kh : A. 2. Câu 15: N c Giaven là h n h p các ch t: ả ứ PbCl2 + Cl2 + 2H2O 2NO2 + Cl2 + 2H2O ể ệ ợ ỗ A. NaCl, NaClO, H2O
3). Thu c th dùng đ nh n bi D. dung d ch I
2
2
ủ
ị
ẩ c Giaven có tính t y màu và sát trùng Câu 17: (CĐ11) Khí nào sau đây không b oxi hóa b i nu c Giaven: ộ ạ Câu 18: B t vôi s ng (CaO), b t g o, b t th ch cao (CaSO ộ ạ b t g o: A. dung d ch HCl 2SO4 Câu 19: dung d ch axit nào sau đây không th ch a trong bình th y tinh:
D. HF
ị
ẽ
ố
ị
Câu 20: đ dung d ch AgNO
A. HCl ổ A. NaF
B. H2SO4 C. HNO3 3 vào dung d ch mu i nào sau đây s không có ph n ng: B. NaBr
ả ứ D. NaCl
C. NaI
ở ớ A. HCHO. B. H2S. C. CO2. D. SO2 ạ ộ ố ố ử ể ế t ị ị ậ ị ộ 4.2H2O), b t đá vôi (CaCO C. dung d ch Br ị ộ B. dung d ch Hị ể ứ
Câu 21: (CĐ07)Cho kim lo iạ M tác d ngụ với Cl2 được mu iố X; cho kim lo iạ M tác d ngụ với dung dịch HCl được mu iố Y. N uế cho kim lo iạ M tác d ngụ v iớ dung dịch mu iố X ta cũng được mu iố Y. Kim lo iạ M có th làể B. Al. ị ị ị ứ ượ D. Fe. ỳ C. Zn. ứ ỳ c, qu tím ỏ ể D. tím C. xanh B. không màu
ị ầ ể ị ủ ị
0,3 B. 0,4 D. 0,2
2 bay ra. Kh i l
ỗ ợ C. 0,1 ị ố ượ ư ấ ộ ớ ố ng mu i thu
B. 45,5g C. 55,5g 40,5g
2 (đktc). Giá tr c a V:
ặ ư ế ớ ượ ị ị ủ c V lít khí Cl
B. 6,72 lít 3,36 lít
D. 5,60 lit ư C. 8,40 lít ớ ượ ế ủ ạ ố ị ủ c k t t a A, đem A phân h y ượ ủ ạ ố ụ c 1,08g b c. Tên c a mu i X: A.
B. natri bromua D. natri florua C. natri iotua Natri clorua A. Mg. ổ Câu 22: Đ dung d ch ch a 1g HBr vào dung d ch ch a 1g NaOH. Nhúng qu tím vào dung d ch thu đ chuy n sang màu: A. đ Câu 23: (ĐHA14) đ trung hòa 20 ml dung d ch HCl 0,1M c n 10 ml dung d ch NaOH x mol/l. Giá tr c a x là: A. ụ Câu 24: cho 20g h n h p b t Mg, Fe tác d ng v i dung d ch HCl d th y có 1g khí H c:ượ đ A. D. 65,5g ả ứ Câu 25: (CĐ14) cho 23,7g KMnO4 ph n ng h t v i dung d ch HCl đ c d thu đ A. Câu 26: cho 1,03g mu i natrihalogenua X tác d ng v i dung d ch b c nitrat d thu đ hoàn toàn đ A.
ả ứ ự ệ ế ề ệ ế ọ ỗ ộ ng trình hóa h c th c hi n dãy bi n hóa sau (m i mũi tên là m t ph n ng,ghi rõ đi u ki n n u có)
Ự Ậ T LU N ươ ế t ph Câu 1: `Vi NaCl(cid:0) Na(cid:0)
c Giaven HCl⇄ Cl2(cid:0)
AgCl (cid:0) clorua vôi
ướ HCl(cid:0) ế ử ố ệ ọ ấ m t nhãn sau: NaCl, NaF, NaBr, NaI
ươ ủ ứ ọ t trong các l 2 > Br2 > I2
Cl2(cid:0) ấ ự t các ch t đ ng riêng bi ng trình hóa h c ch ng minh tính oxi hóa c a Cl ạ ỉ ế ả n HClO(cid:0) ậ ộ Câu 2: Ch dùng m t thu c th nh n bi Câu 3: Vi Câu 4: Gi
t ph i thích t ề i sao: ế ể ặ ậ 2SO4 đ m đ c
ố ị ủ ả a, Khi đi u ch khí hiđro clorua ph i dùng mu i NaCl tinh th và axit H ể ự b, Không dùng bình th y tinh đ đ ng dung d ch HF
Ớ
L P 10 CB
ỹ
Cô :Thu v Tel: 0932.546.381
2014
ố ượ ừ ủ ượ ị c 2,24 lít khí (đktc). Tính % kh i l ủ ng c a Cu ỗ
ớ ượ ầ ỗ ớ ị ượ ng c n dùng) thu đ c 8,96 ấ ư ể ố ượ ủ ợ ỗ ị
o th
ng c a m i kim lo i trong h n h p và th tích dung d ch HCl đã dùng. ụ ạ ặ ư ẫ ườ ị ng). ỗ ợ Câu 5: Hòa tan 12g h n h p Fe, Cu vào dung d ch HCl v a đ thu đ ượ ố ố ượ ợ trong h n h p và kh i l c. ng mu i thu đ ụ ợ Câu 6: Cho 11g h n h p Al và Fe tác d ng v i dung d ch HCl 0,5M (l y d 10% so v i l ỗ lít khí (đktc). Tính % kh i l Câu 7: Cho 69,6g MnO2 tác d ng v i dd HCl đ c d , d n khí thoát ra đi vào 500 ml dung d ch NaOH 4M ( t
ả ế ươ
t ph ị ả ứ ế ị ả ứ ổ t V sau ph n ng không thay đ i)
ộ Ầ ớ ả ứ ng trình ph n ng x y ra a, Vi ủ ấ ồ b, Xác đ nh n ng đ mol c a các ch t có trong dung d ch sau ph n ng (bi Ắ
Ệ
A.
O
+1 1
o
ả ố
ĐÁP ÁN PH N TR C NGHI M 1C2C3D4B5C6C (MnO2, KClO3)7A8A9C10A11B12D13B H2 ( s OXH gi m ) 14A (HCl
ố
2 thì HCl là ch t khấ
Cl2(s OXH tăng) : ạ ử ấ 2 thì HCl là ch t oxi hóa, t o Cl
Nên t o Hạ 15A16A17C18D19D20A21D22C23D24C25C26B
ệ
ắ
ả
ẫ
ướ
ầ i câu 24, 25 ,26 ph n tr c nghi m:
H2
H ng d n gi Câu 24: nH2 = 0,5 mol Có: 2HCl (cid:0) 1 mol ←0,5 mol
(cid:0) nCl = nHCl = 1 mol (cid:0) mmu i ố = m hh(Fe+Mg) + mCl
ế
ươ
ng trình
+2
= 20 + 1. 35,5 = 55,5g : ể
t ph ườ
ố
ố
ế ậ ủ
ố
ả ế ợ
ạ
ạ
ố
Câu 25: Cách vi ạ ỉ ố ng axit chuy n xu ng Mn mà ch có 1 g c axit là g c Cl nên t o KMnO4 trong môi tr ạ ể MnCl2, Cl trong HCl có s oxi hóa 1 chuy n lên s oxi hóa k c n c a Cl là 0 nên t o Cl2, K ph i k t h p v i g c axit t o mu i nên t o KCl và có H, O t o H
2O
MnCl2 + Cl2 + KCl + H2O
ố ạ ớ ố KMnO4 + HCl (cid:0)
1
ả ứ
ử
+2
0
ằ +7
MnCl2 + Cl2 + KCl + H2O
Cách cân b ng ph n ng oxi hóa kh KMnO4 + HCl (cid:0)
+2
0 Cl2 + 2e
Mn x 2
ư ệ ố
x 5 ỗ
ố
ỗ
ố
Đ a h s vào v ph i tr
c, ch nào có Cl
2 cho s 5, ch nào có Mn cho s 2
2 MnCl2 + 5Cl2 + KCl + H2O
ế ế ả
+7 Mn + 5e (cid:0) 1 2Cl (cid:0) ả ướ ế KMnO4 + HCl (cid:0) Bên v ph i có 2 Mn nên cho 2 Mn vào v trái 2KMnO4 + HCl (cid:0)
2 MnCl2 + 5Cl2 + KCl + H2O
ả Khi đó có 2K nên ph i thêm 2KCl
2 MnCl2 + 5Cl2 + 2KCl + H2O
2KMnO4 + HCl (cid:0) ế ố
ổ
ả
Sau đó tính t ng s Cl bên v ph i là 16 nên cho 16 HCl, 16HCl có 16H nên 16
chia 2 là 8H2O.
2 MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16 HCl (cid:0)
Ớ
L P 10 CB
ỹ
Cô :Thu v Tel: 0932.546.381
2014
ả ế ế ả ứ ằ ế ươ i theo ph t vi t ph n ng và cân b ng ng pháp vi Cách 1: gi
2 MnCl2 + 5Cl2 + 2KCl + 8H2O
ả ứ t ph n ng: Bi 2KMnO4 + 16 HCl (cid:0) 0,15 mol (cid:0) 0,375 mol (cid:0) VCl2 = 0,375 . 22,4 = 8,4 lít
+2 Mn
+7 Mn + 5e (cid:0) 0,75 mol
ươ ố ườ ố Cách 2: theo ph ng pháp electron: s mol e nh ậ ng = s mol e nh n
0
1 2Cl (cid:0)
0,15 mol (cid:0)
Cl2 + 2e
1.75,0 2
0,375 ← 0,75 mol ( = 0,375)
(cid:0)
AgX + NaNO3
VCl2 = 0,375 . 22,4 = 8,4 lít Câu 26: NaX + AgNO3 (cid:0) 0,01 mol ← 0,01 mol
AgX (cid:0) Ag + X2
(cid:0) = 103 (cid:0) X là Br(cid:0) NaX = NaBr (Natri bromua) M NaX = MX = 103 – MNa = 103 – 23 = 80 (cid:0) 0,01 mol ←0,01 mol 03,1 01,0
ƯỚ
Ầ Ự Ậ
Ả
B.
H
NG D N GI I PH N T LU N
NaCl
Ẫ Câu 1: Na + Cl2 (cid:0)
< 2500C
Ánh sáng
NaCltinh th ể + H2SO4 đ cặ NaHSO4 + HCl to 4HClđ cặ + MnO2 (cid:0) MnCl2 + Cl2 + 2H2O
NaCl + NaClO + H2O
Ánh sáng
Cl2 + H2 2HCl Cl2 + NaOH (cid:0) Cl2 + H2O ⇄ HCl + HClO
3
Ánh sáng
↓ AgCl + HNO HClO HCl + O2 HCl + AgNO3 (cid:0)
30oC
AgCl
Ag + Cl2 CaOCl2 + H2O
3
tính oxi hóa Cl2 > Br2
NaCl + Br2 (cid:0) NaBr + I2 (cid:0) tính oxi hóa Br2> I2
Cl2 + Ca(OH)2 ị Câu 2: dùng dung d ch AgNO Câu 3: Cl2 + NaBr (cid:0) Br2 + NaI (cid:0) (cid:0) tính oxi hóa Cl2 > Br2> I2
Ớ
L P 10 CB
ỹ
Cô :Thu v Tel: 0932.546.381
2014
ề ấ ướ ể ả ặ ể Câu 4: a, vì khí HCl tan r t nhi u trong n c nên ph i dùng NaCl tinh th và H ạ 2SO4 đ c đ HCl t o thành không hòa tan trong n c.ướ
2)
ồ ậ ằ ủ ủ ủ ầ ấ b, vì axit flohiđric (HF) có tính ch t ăn mòn các đ v t b ng th y tinh (thành ph n chính c a th y tinh là SiO
SiF4 + 2H2O
4HF + SiO2 (cid:0) không x y raả Câu 5: Cu + HCl (cid:0)
.4,6
← Fe + 2HCl (cid:0) 0,1 mol FeCl2 + H2 0,1mol 0,1mol (cid:0) mFe = 0,1. 56 = 5,6g (cid:0)
(cid:0) = 53,33% % Cu = m Cu = 12 – 5,6 = 6,4g %100 12
ạ
ố
ạ + m g c axit
ượ ố ng mu i thu đ c: = 0,1. 127 = 12,7g
Cách 1: ố ượ Kh i l Cách 2: mmu i ố = m kim lo i/hh kim lo i
H2
←
2 g m Fe và g c Cl nên ch l y kh i l
(cid:0) mCl = 0,2. 35,5 = 7,1g (cid:0) ố ượ ỉ ấ ồ ố ộ ng c a m t nguyên
2HCl (cid:0) 0,2 mol 0,1mol nCl = nHCl = 0,2 mol (cid:0) mFeCl2 = mFe + mCl = 5,6 + 7,1 = 12,7g ( mu i FeCl
ử ộ ủ ứ t Fe c ng kh i l
Fe + mSO4
ố ượ ố ử ố ượ ụ Ví d : mu i Fe ủ ố ử Cl, không quan tâm trong công th c đó có bao nhiêu nguyên t ) ố ng mu i = m ộ ng c a m t nguyên t 2(SO4)3 thì kh i l
Câu 6: a, 2Al + 6HCl (cid:0)
x mol(cid:0) x x
Fe + 2HCl (cid:0) 2AlCl3 + 3H2 3x 2 FeCl2 + H2 y y 2y y mol(cid:0) Theo đ : mề (cid:0)
hhkim lo iạ = mAl + mFe = 11 27x + 56y = 11 96,8 4,22
+ y = = 0,4 nH2 =
x
y
3x 2 11
56
x
y
2,0 1,0
y
4,0
27 x 3 2
.4,5
(cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0) (cid:0)
.6,5
%Al = = 49,09% mAl = 0,2. 27 = 5,4g (cid:0)
%100 11 %100 11
%Fe = = 50,91% mFe = 0,1.56 = 5,6 (cid:0)
ặ ho c %Fe = 100 – 49,09 = 50,91%
4,0 5,0
= 0,8 lít nHClpứ = x + 2y = 0,2 + 2. 0,1 = 0,4 mol; CM HCl = 0,5M VHClpứ =
HCld ư =
10.8,0 100
ấ ư ớ ượ ả ứ vì HCl l y d 10% so v i l ng ph n ng nên V = 0,08 lít
(cid:0) VHCl dùng = VHClpứ + VHCldư = 0,8 + 0,08 = 0,88 lít
Ớ
L P 10 CB
ỹ
Cô :Thu v Tel: 0932.546.381
2014
Câu 7: a, MnO2 + 4HCl (cid:0) MnCl2 + Cl2 + 2H2O
Cl2 + NaOH (cid:0) NaCl + NaClO + H2O
6,69 87
b, nMnO2 = = 0,8 mol ; nNaOH = 0,5. 4 = 2 mol
NaOH = 0,5 lít
MnO2 + 4HCl (cid:0) 0,8 mol(cid:0) Cl2 + 2NaOH (cid:0) MnCl2 + Cl2 + 2H2O 0,8 mol NaCl + NaClO + H2O 1,6 mol 0,8 mol 0,8 mol 0,8 mol(cid:0) (cid:0) ể ả ứ ấ ư nNaOHd ư = 2 1,6 = 0,4 ổ Vì th tích không đ i nên V = V Sau ph n ng có các ch t: NaCl, NaClO và NaOH d
8,0 5,0
= 1,6M CM(NaCl) = CM(NaClO) =
4,0 5,0
= 0,8M CM(NaOHdư )=
ể ề ệ ọ ọ ọ ố ơ ế ầ t h n môn hóa, cô có vi t thêm ph n ộ ố ạ ầ ự ậ ả ướ Đ giúp m t s b n h c sinh không có đi u ki n h c thêm và h c t ẫ ng d n gi i ph n t lu n. h ọ ố Chúc các em h c t t!
Ớ
L P 10 CB